1. 서론
2. 재료 및 방법
2.1 생물 채집 및 관리배양
2.2 이산화탄소 농도와 온도 실험
2.3 측정
3. 결과
3.1 상대생장률
4. 고찰
5. 결론
1. 서론
대기와 해양에서의 이산화탄소 농도는 최근 연간 약 2 ppm 정도 급속하게 증가하고 있다(Moreira and Pires 2016). 대기 중 이산화탄소의 농도는 산업혁명 전 280 ppm에서 2014년 400 ppm 이상을 기록하였으며 향후 100년 이내 750 ppm으로 증가하여 2300년에는 2,000 ppm까지 상승할 것으로 예측되었다(IPCC 2014). 대기 중 이산화탄소의 증가는 기온 상승에 영향을 미치고 대기에서 발생되는 이산화탄소의 약 30%를 해양이 흡수함으로써 해양의 pH 감소와 용존 산소 농도 감소로 이어져(Zeebe et al. 2008; Campbell et al. 2014; Joos 2015) 지구 온난화와 해양 산성화를 초래할 수 있다. 지구의 평균기온은 지난 133년간(1880~2012년) 0.85℃ 상승하였으며 현재처럼 지속적으로 온실가스 배출 시 21세기 말 평균기온은 3.7℃ (2.6~4.8℃) 상승할 것으로 예측되었다(IPCC 2014).
대기 중 이산화탄소 농도와 온도의 상승은 대부분 해양으로 흡수되어 해양생태계내의 영향을 미치게 되며 그 과정에서 해조류에 의한 이산화탄소 고정 등 해양생태계의 역할이 매우 중요하게 인식된다(Kohfeld et al. 2005). 특히 연안지역은 기후 변화와 관련된 생물체 영향이 가장 극심할 것으로 예상되며(Pachauri et al. 2014), 해조류는 이러한 연안 일차 생산자로 이산화탄소를 흡수하여 태양광을 에너지원으로 광합성을 수행하며, 유영생물 및 무척추동물의 산란처와 서식처로서 이용되고 있다. 뿐만 아니라 해양 바이오매스 및 신재생에너지 개발, 생태계 서비스 제공 등과 같이 해양 생태계에서 매우 중요한 역할을 하고 있다(Han 2008; Gram et al. 2009). 해조류는 지구온난화로 인한 수온상승과 해양 산성화에 대해 생리적으로 다양한 반응을 보이는 것으로 알려져 있다(Connell and Russell 2010; Nikinmaa 2014).
온난화와 산성화에 대한 해조류는 엇갈린 반응이 관찰되어왔다. 해조류는 광합성을 위해 이산화탄소와 중탄산(HCO3-) 모두 무기 탄소원으로 활용하므로 이산화탄소의 증가는 비효율적인 중탄산 경로의 사용이 감소되어 해양내 높은 이산화탄소 농도에서 궁극적으로 생장과 광합성 반응이 증가하는 것으로 나타났다(Axelsson et al. 2000). 온도 상승의 경우 해조류 체내의 물질대사, 생화학 성분 및 광합성에 부정적 영향을 미칠 수 있다고 알려져 있다(Harley et al. 2012; Koch et al. 2013). 이러한 해양 산성화와 온도 변화의 상호작용은 각각의 스트레스 요인만으로 인한 것과는 다른 생리적인 반응을 초래할 수 있으며(Brown et al. 2014) 이는 생물다양성 변화에 따른 생태계 전반적으로 영향을 미칠 수 있다. 해양 산성화와 온도 증가에 따른 해조류의 생리학적 연구는 상대적으로 산호종에 집중되어 있는 반면 해조류에 대한 연구는 미미하다. 따라서 해양 산성화와 온도의 상호작용에 따른 다양한 해조류의 연구가 필요할 것이다(Nelson 2009).
지누아리의 경우 전 세계적으로 널리 분포하고 있는 홍조류로서 한천의 주원료 및 다양한 기능성 소재로서의 가치를 인정받아 경제적으로 중요한 종으로 국내의 경우 남해안과 동해안 조하대에 우점하고 있는 것으로 알려져 있다. 지누아리의 잠재적인 중요성에도 불구하고 온도 및 이산화탄소 변화와 같은 기후변화에 따른 성장 및 생리학적 특성 연구가 부족한 실정이다 (Jiang et al. 2016). 따라서 본 연구는 지누아리의 생장, 광합성 색소, 영양염 흡수와 같은 생리학적 변화의 측정을 통해 이산화탄소 농도와 온도의 상승으로 인한 복합적인 영향을 알아보고자 수행하였다.
2. 재료 및 방법
2.1 생물 채집 및 관리배양
실험에 사용한 지누아리는 강원도 강릉시 주문진읍 교항리(37°87' 96.5'' N, 128°83' 35.7'' E)의 조간대에서 채집되었다. 현장에서 채집한 엽체는 해수에 적신 페이퍼타올에 감싸 지퍼백에 넣어 밀봉한 뒤, 아이스박스에 담아 저온상태(~4℃)를 유지하며 실험실로 신속하게 운반하였다. 실험에 사용할 샘플은 멸균된 해수로 여러 번 세척 후 정단부 분기한 1~2 마디를 잘라 1 L 플라스크에 넣어 온도 20℃, 광도 80 μmol photons m-2s-1, 광주기 12:12 L:D 조건하에서 약 10일간 순응시켰다. 배양액은 VSE 배지를 사용하였으며 3일 간격으로 배양액 전량을 교환하였으며 동시에 면봉을 이용하여 엽체의 표면을 세척하였다.
2.2 이산화탄소 농도와 온도 실험
항온수조를 이용하여 2가지 온도조건(생장 최적 온도 18℃, 고온 조건 25℃)과 3가지 이산화탄소 농도조건(500, 900, 1,800 ppm)에서 실험을 수행하였다. 이산화탄소의 농도는 소프트웨어 CO2SYS (Lewis and Wallace 1998)을 사용하여 pH를 계산하였으며, 해수 pH 상수는 NBS scale을 사용하였다(Millero et al. 2006). 공기주입 튜브와 이산화탄소 가스 튜브를 하나의 조절기에 연결한 후 이산화탄소 밸브를 이용하여 각 이산화탄소 농도에 해당하는 pH 수준에 도달하도록 조절한 뒤 각각 pH 8.1 (500 ppm), pH 7.8 (900 ppm), pH 7.5 (1,800 ppm)으로 고정하였으며 3일간 시간별 pH 측정을 통하여 모니터링하여 pH의 변화가 없음을 확인한 뒤, 각 조건별 250 ml 플라스크에 염분 30 psu인 VSE 배지를 넣고 순응 후 건강한 엽체를 골라 플라스크당 엽체 0.25 g씩 넣어 각 조건별 3번의 반복구를 두어 배양하였다. 광량 80 μmol photons m-2s-1, 광주기 12:12 L:D 조건에서 20일 동안 배양하였으며 5일간격으로 배양액을 전량 교환해주었다.
2.3 측정
매 5일간격으로 페이퍼타월을 이용하여 엽체 표면의 수분을 제거한 후 생중량을 측정하여 다음과 같은 식으로 상대생장률(Relative Growth Rate, RGR)을 계산하였다.
W1:초기 무게(g), W2:배양 후 무게 T1,T2:배양일수
광합성 색소는 Lichtenthaler and Wellburn (1983)에 따라 Chlorophyll a, Carotenoids, Phycoerythrin, Phycocyanin를 분석하였다.
배양 시작 전 배양액과 배양 후 배양액을 해양환경공정시험기준(MOF 2013)에 따라 용존무기질소(DIN)와 용존 무기인(DIP)을 측정하여 질산염과 인산염의 최대 흡수율(Maximum uptake rate, MUR)을 계산하였다.
모든 실험 결과는 분산분석(ANOVA analysis)으로 유의성 분석을 실시하였으며, 자료에 관한 유의성이 확인되면 Tukey’s test로 사후검정을 실시하였다. 모든 자료 분석은 SPSS Statistics (version. 25.0) 통계프로그램을 이용하여 수행하였다.
3. 결과
시간별 pH 측정으로 이산화탄소 농도 외에 다른 물리적인 pH 변화가 일어나지 않았음을 확인하였으며 이산화탄소 500, 900 ppm에서는 광합성을 하는 낮 시간대와 호흡을 하는 밤 시간대 모두 8.0~8.2로 유지되었으며, 고농도의 이산화탄소 1,800 ppm의 경우 낮과 밤 시간대 모두 7.1~7.4로 측정되었다.
3.1 상대생장률
매 5일간격으로 무게를 측정한 결과 모든 조건에서 무게가 증가하는 것으로 나타났다. 상대생장률은 배양 후 10, 15, 20일 후 측정한 결과를 대상으로 평균값을 계산하였다. Tukey’s test 결과 18℃와 25℃ 모두 이산화탄소에 따른 유의한 차이가 없었으며(p > 0.05, Fig. 1) 1,800 ppm 고농도 이산화탄소 조건에서 온도가 상승함에 따라 상대생장률이 감소하는 결과가 나타났다(p < 0.05).
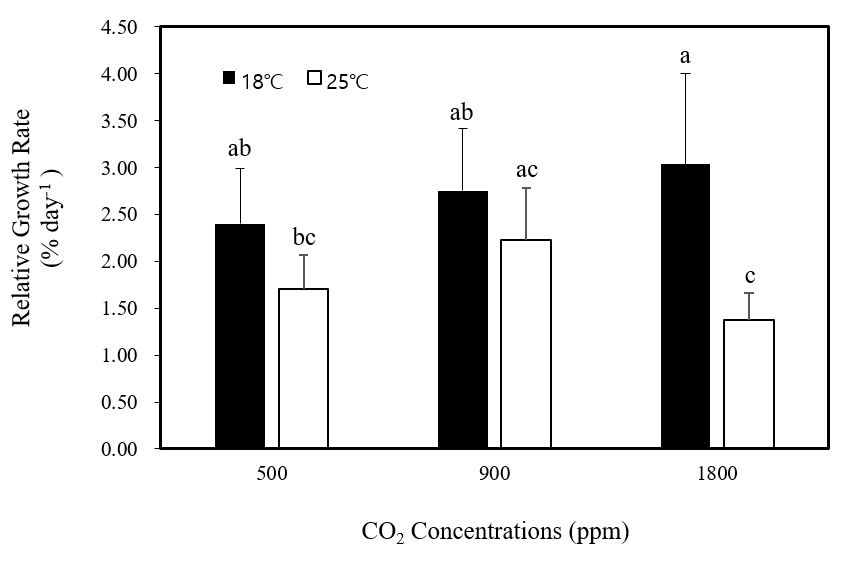
Fig. 1
Effects of CO2 on relative growth rates of Grateloupia filicina at different temperatures. Mean ± standard error (n=3).
지누아리의 광합성 색소(R-phycoerythrin, R-phycocyanin, Chlorophyll a, Carotenoids)를 측정한 결과 R-phycoerythrin의 경우 18℃, 25℃ 두 온도 조건에서 이산화탄소의 농도 대비 색소량 차이는 없었으며(Fig. 2a), R-phycocyanin의 경우 18℃에 비해 25℃에서 낮은 함량이 관찰되었다(Fig. 2b). Chlorophyll a (Fig. 2c)의 경우 모든 이산화탄소 농도에서 18℃에 비해 25℃에서 높은 함량을 보였다. Carotenoids의 경우 모든 조건에 통계적으로 유의한 차이를 보이지 않았으며 온도 및 이산화탄소에 따른 경향성도 보이지 않았다(Fig. 2d). 모든 광합성 색소 함량의 경우 통계학적으로 의미 있는 차이를 보이지는 않았다.
지누아리의 인산염 흡수율 연구 결과 통계학적으로 이산화탄소 농도에 따른 유의한 차이는 없었으며 18℃, 25℃ 모두 이산화탄소 900 ppm에서 가장 높은 흡수율을 보였다. 18℃와 25℃ 조건을 비교한 결과 온도가 상승함에 따라 이산화탄소 모든 농도에서 인산염 흡수율이 감소하였으며, 18℃의 경우 500 ppm 조건에서 가장 낮은 인산염 흡수율(26.09 μmol g-1 FW d-1)을 나타낸 반면 25℃의 경우 1,800 ppm 고농도에서 가장 낮은 인산염 흡수율(13.57 μmol g-1 FW d-1)을 나타냈다(p < 0.05; Fig. 3a).
질산염 흡수율의 경우 인산염 흡수율과 비슷한 경향성이 관찰되었다. 18℃ 경우 900 ppm > 1,800 ppm > 500 ppm 순으로 질산염 흡수율이 나타났으며, 25℃의 경우 900 ppm > 500 ppm > 1,800 ppm 순으로 관찰되어 이산화탄소 농도에 따른 통계학적 유의한 차이는 없었으나 500 ppm을 제외하고 18℃에 비해 25℃ 조건에서 질산염 흡수율이 감소하였다(p < 0.05). 특히 25℃, 1,800 ppm 조건에서 가장 낮은 질산염 흡수율(22.40 μmol g-1 FW d-1)을 보였다(Fig. 3b).
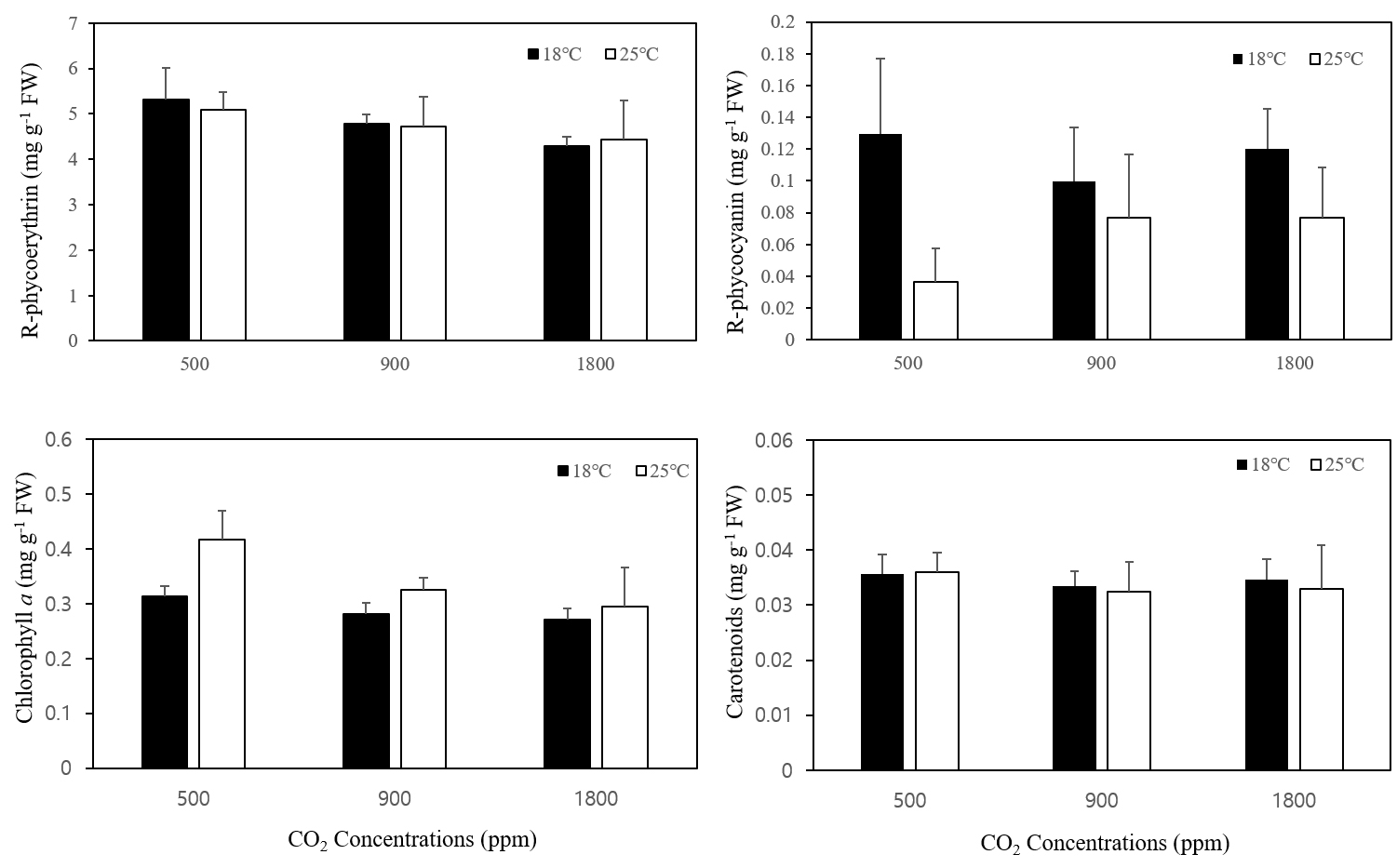
Fig. 2
Effects of CO2 and temperature on R-phycoerythrin (a), R-phycocyanin (b), Chlorophyll a (c), and Carotenoids (d) contents of Grateloupia filicina. Mean ± standard error (n=3).
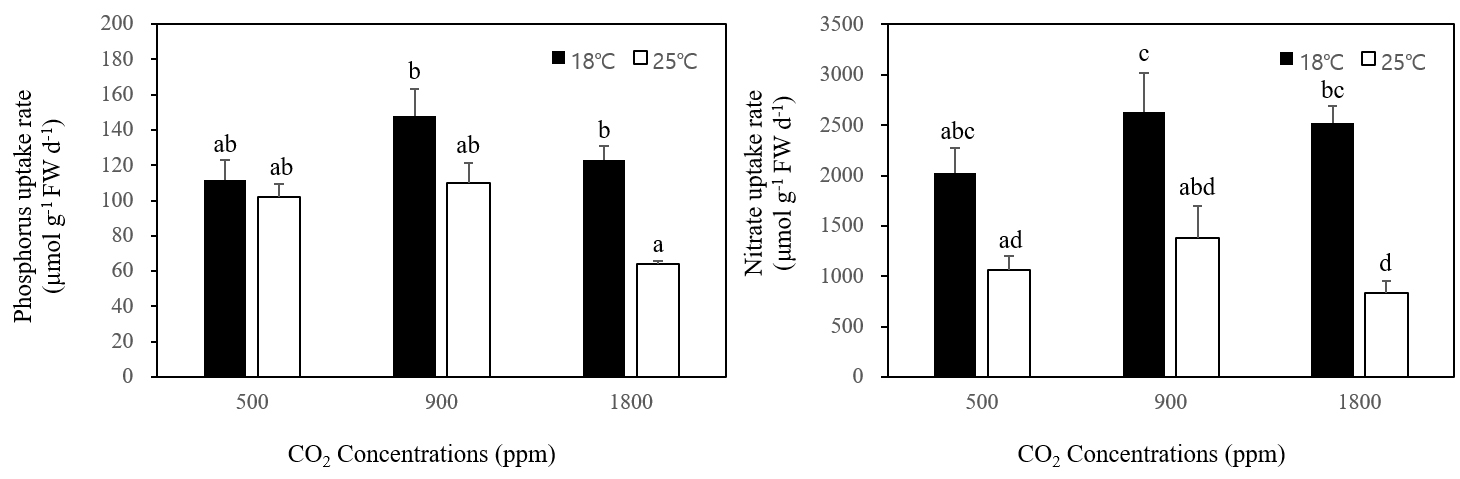
Fig. 3
Phosphorus (a) and nitrate (b) uptake rates of Grateloupia filicina at different CO2 and temperatures. Mean ± standard error (n=3).
4. 고찰
대기와 해양의 이산화탄소 농도가 상승하면 여러 가지 물리적, 화학적 변화가 발생하게 된다. 해조류의 경우 다양한 탄소 획득 전략을 가지고 있어 이산화탄소 농도가 증가하였을 때 생리활성이 증가할 것으로 예측되었다(Hepburn et al. 2011; Cornwall et al. 2017; van der Loos et al. 2019). 선행 연구 결과, 이산화탄소 농도의 증가에 따라 홍조류 Hypnea spinella, Melanothamnus harveyi와 Neopyropia leucosticta의 생장을 감소시키지만 Lomentaria articulata의 경우 생장률이 오히려 증가한 것으로 나타나(Kubler et al. 1999; Mercado et al. 1999; Suarez-Alvarez et al. 2012; Olischlager and Wiencke 2013) 생장 및 광합성에 있어 종별로 다양하게 반응하는 것으로 나타났다. 본 연구 결과, 이산화탄소 농도에 따른 유의한 차이가 없었으나 고온(25℃), 고농도의 이산화탄소(1,800 ppm) 조건에서 생장이 현저하게 감소하는 것으로 나타나 이산화탄소 뿐만 아니라 본 연구 종인 지누아리의 경우 이산화탄소 농도 뿐 아니라 온도의 상승이 생장을 감소시키는 것으로 나타났다. 이는 잠재적인 해양 산성화 연구를 위해서 이산화탄소 농도 뿐 아니라 수온상승과의 다중 효과를 고려해야 함을 시사한다(Harley et al. 2012).
온실가스 농도 증가에 기반한 수온상승에 대해 일반적으로 해조류 내 단백질 함량의 변화와 세포막 특성을 포함하는 생화학적 및 생리학적 적응으로 온도에 대한 내성을 나타내지만(Eggert 2012), 그럼에도 불구하고 너무 높은 온도와 낮은 온도의 경우 세포 내 파괴적 스트레스를 초래하며 이에 대응하여 생장을 감소시키고 대사를 지연시키는 것으로 알려져 있다(Davison and Pearson 1996; Eggert et al. 2010). 본 연구 결과 이산화탄소 및 온도의 따른 유의한 차이가 나타나지 않았으나 1,800 ppm 고농도 이산화탄소 조건에서 온도가 상승함에 따른 생장률의 감소가 나타났다(p < 0.05). 이는 적정 범위 내의 온도 증가에 의해 성장이 증가할 수 있으나 고온에서는 호흡과 같은 에너지 소비가 증가하여 생장의 감소가 나타날 수 있으며, 더불어 고온에 의한 세포 용해율 증가로 인한 생장의 감소가 나타날 수 있다(Zou and Gao 2013).
Chen et al. (2018)에 의하면 Gracilaria lemaneiformis는 생장온도가 상승함에 따라 Chlorophyll a와 Carotenoids의 함량이 증가하였고, 이와 유사하게 Agarophyton vermiculophyllum의 Chlorophyll a와 Carotenoids의 함량 또한 고온에서 증가하는 결과가 관찰되었다(Samanta et al. 2019). 이는 해조류가 고온과 같은 환경적 스트레스에 노출되었을 때 생리적 균형을 유지하기 위하여 더 높은 대사활성을 나타내는 것으로 설명할 수 있다(Machaleck et al. 1996). 본 연구의 경우 지누아리의 광합성 색소 함량은 이산화탄소 농도 및 온도에 따른 유의한 차이는 나타나지 않았으나, 일부 고온 및 고농도의 이산화탄소 조건(25℃, 1,800 ppm)에서 엽체 내 색소 탈색이 관찰되었으나 광합성 색소의 양적 변화는 확인되지 않았다. 온도, 이산화탄소, 건조, 자외선, 염도 등 다양한 환경요인 간에 상호작용이 발생하며, 일부 석회조류에서 색소의 탈색에 온도 상승은 높은 이산화탄소 조건에서 부정적인 영향을 주는 것으로 나타났다(Anthony et al. 2008; Diaz-Pulido et al. 2012). 온도 및 이산화탄소와 같은 개별적인 환경요인에 대한 생리학적 연구는 수행되어왔으나, 고온 및 고농도 이산화탄소와 같은 상호작용에 대한 프로세스는 명확하게 알려져 있지 않았지만 이산화탄소에 의한 탄소 농축메커니즘(Leggat et al. 1999), 광호홉(Kim et al. 2004) 및 산화 스트레스(Gao and Zheng 2010) 등의 영향을 예측할 수 있다.
Xu et al. (2010)에 의하면 G. lemaneniformis 배양 시 이산화탄소의 농도가 370 ppm에서 720 ppm으로 증가함에 따라 인과 질산염의 흡수율이 증가하였으며 이는 ATP 합성 및 엽록체 활성을 통한 높은 생장률을 위한 것으로 추정하고 있다. 지누아리의 경우 이와 유사하게 18℃ 조건에서, 이산화탄소 농도가 500 ppm에서 900 ppm으로 증가함에 따라 인과 질산염의 흡수율이 증가하였으며 고농도 1,800 ppm에서 900 ppm 보다 낮은 수치를 보였다. 25℃의 경우 모든 이산화탄소 농도에서 18℃에 비해 크게 영양염 흡수율이 감소되어(p < 0.05) 온도에 의해 큰 영향을 받는 것으로 추정할 수 있다. Smit (2002)에 의하면 G. gracilis의 질산염 흡수율에 대해 Michaelis-Menten 모델을 사용하여 분석하였다. 그 결과 질산염 흡수율은 저농도의 질소농도 및 온도의 영향을 받는 것으로 나타났으며 이는 스트레스 요인에 따른 생장률 감소로 인한 영양염 흡수율이 감소하는 것으로 설명할 수 있으며, 본 연구결과 고온의 조건에서 생장률과 영양염 흡수율이 저해되어 일치하는 결과를 나타냈다.
5. 결론
본 연구는 두 개의 다른 온도에서 이산화탄소 농도 차이에 따른 지누아리의 생장률, 광합성 색소 함량 그리고 영양염 흡수율의 변화를 관찰하였으며 그 결과 광합성 색소의 경우 온도와 이산화탄소 농도 차이에 따른 변화가 나타나지 않았으나(p > 0.05), 고온과 고농도의 이산화탄소 배양조건에서 생장률과 영양염 흡수율이 감소하는 결과를 나타냈다(p < 0.05). 따라서 지구 온난화로 인해 상승되는 온도와 이산화탄소 증가로 인한 해양 산성화가 지속될 경우 지누아리의 생장이 잠재적으로 감소할 것으로 판단된다. 수온상승 및 해양 산성화에 따른 지누아리의 생리학적 연구의 경우 향후 기후변화에 대한 대응방안의 기초가 될 수 있으며 이를 위해 장기적으로 해조류의 생리, 생태학적 연구가 필요할 것으로 사료된다.
Acknowledgements
본 연구는 2017년도 정부(교육부)의 재원으로 한국연구재단의 기초연구사업(No. NRF-2017R1A6A1A06015181)과 국립수산과학원 갈조류(미역, 다시마) 신품종 개발 및 양식 방법 연구(R2021005) 과제의 지원에 의해 수행되었습니다.
References
Anthony KRN, Kline DI, Diaz-Pulido G, Dove S and Hoegh-Guldberg O. 2008. Ocean acidification causes bleaching and productivity loss in coral builders. Proceedings of the National Academy of Sciences. 105(45), 17442-17446.
10.1073/pnas.080447810518988740PMC2580748Axelsson L, Mercado J and Figueroa F. 2000. Utilization of HCO
3− at high pH by the brown macroalga
Laminaria saccharina. European Journal of Phycology 35(1), 53-59.
10.1017/S096702629900253XBrown MB, Edwards MS and Kim KY. 2014. Effects of climate change on the physiology of giant kelp,
Macrosystis pyrifera, and grazing by purple urchin,
Strongylocentrotus purpuratus. Algae 29(3), 203-215.
10.4490/algae.2014.29.3.203Campbell AL, Mangan M, Ellis RP and Lewis C. 2014. Ocean acidification increases copper toxicity to the early life history stages of the polychaete arenicola marina in artificial seawater. Environmental Science and Technology 48(16), 9745-9753.
10.1021/es502739m25033036Chen B, Zou D, Du H and Ji Z. 2018. Carbon and nitrogen accumulation in the economic seaweed
Gracilaria lemaneiformis affected by ocean acidification and increasing temperature. Aquaculture 482, 176-182.
10.1016/j.aquaculture.2017.09.042Connell SD and Russell BD. 2010. The direct effects of increasing CO
2 and temperature on non-calcifying organisms: increasing the potential for phase shifts in kelp forests. Proceedings of the Royal Society B: Biological Sciences 277(1686), 1409-1415.
10.1098/rspb.2009.206920053651PMC2871943Cornwall CE, Revill AT, Hall-Spencer JM, Milazzo M, Raven JA and Hurd CL. 2017. Inorganic carbon physiology underpins macroalgal responses to elevated CO
2. Scientific Reports 7, 46297.
10.1038/srep4629728417970PMC5394685Davison IR. and Pearson GA. 1996. Stress tolerance in intertidal seaweeds. Journal of Phycology 32, 197-211.
10.1111/j.0022-3646.1996.00197.xDiaz-Pulido G, Anthony KRN, Kline DI, Dove S and Hoegh-Guldberg O. 2012. Interactions between ocean acidification and warming on the mortality and dissolution of coralling algae. Journal of Phycology 48, 32-39.
10.1111/j.1529-8817.2011.01084.x27009647Edenhofer O, eds. 2014. Climate Change 2014: Mitigation of Climate Change. Contribution of Working Group III to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change; IPCC. Cambridge University Press: Cambridge, UK.
Eggert A. 2012. Seaweed responses to temperature. In Wiencke C and Bischof K eds, Seaweed Biology. Springer‐Verlag, Berlin, Germany, 47-66.
10.1007/978-3-642-28451-9_3Eggert A, Peters AF and Küpper FC. 2010. The potential impacts of climate change on endophyte infections in kelp sporophytes. In Israel A, Einav R and Seckbach J, eds, Seaweeds and Their Role in Globally Changing Environments. Springer, New York, 139-54.
10.1007/978-90-481-8569-6_9Gao K and Zheng Y. 2010. Combined effects of ocean acidification and solar UV radiation on photosynthesis, growth, pigmentation and calcifiacation of the coralline alga Corallina sessilis(Rhodophyta). Global Change Biology 16(8), 2388-2398.
10.1111/j.1365-2486.2009.02113.xGram LE, Gram JM and Wilcox LW. 2009. Algae. Benjamin Cumming. New York. U.S.A., 616.
Han SO. 2008. Algae based energy materials. New and Renewable Energy 4(4), 50-55.
Harley CD, Anderson KM, Demes KW, Jorve JP, Kordas RL, Coyle TA and Graham MH. 2012. Effects of Climate Change on Global Seaweed Communities. Journal of Phycology 48(5), 1064-1078.
10.1111/j.1529-8817.2012.01224.xHepburn CD, Pritchard DW, Cornwall CE, McLeod RJ, Beardall J, Raven JA and Hurd CL. 2011. Diversity of carbon use strategies in a kelp forest community: implications for a high CO
2 ocean. Global Change Biology 17(7), 2488-2497.
10.1111/j.1365-2486.2011.02411.xIntergovernmental Panel on Climate Change (IPCC). 2014.
Climate change 2014: synthesis report. Contribution of Working Groups I, II and III to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change . eds. by Core Writing Team, Pachauri RK and Meyer LA, IPCC, Geneva, Switzerland, 151.
10.1017/CBO9781107415416Jiang H, Zou D and Li X. 2016. Growth, photosynthesis and nutrient uptake by
Grateloupia livida (Halymeniales, Rhodophyta) in response to different carbon levels. Phycologia 55(4), 462-468.
10.2216/16-11.1Joos F. 2015. Global warming: growing feedback from ocean carbon to climate. Nature 522(7556), 295-296.
10.1038/522295a26085267Kim Y, Yakunin AF, Kuznetsova E, Xu X, Pennycooke M, Gu J and Christendat D. 2004. Structure-and function-based characterization of a new phosphoglycolate phosphatase from
Thermoplasma acidophilum. Journal of Biological Chemistry 279(1), 517-526.
10.1074/jbc.M30605420014555659PMC2795321Koch M, Bowes G, Ross C and Zhang XH. 2013. Climate change and ocean acidification effects on seagrasses and marine macroalgae. Global Change Biology 19(1), 103-132.
10.1111/j.1365-2486.2012.02791.xKohfeld KE, Le Quere C, Harrison SP and Anderson RF. 2005. Role of marine biology in glacial-interglacial CO
2 Cycles. Science 308, 74-78.
10.1126/science.110537515802597Kübler J, Johnston A and Raven J. 1999. The effects of reduced and elevated CO
2 and O2 on the seaweed
Lomentaria articulata. Plant Cell & Environment 22(10), 1303-1310.
10.1046/j.1365-3040.1999.00492.xLeggat W, Badger MR and Yellowlees D. 1999. Evidence for an inorganic carbon-concentrating mechanism in the symbiotic dinoflagellate
Symbiodinium sp. Plant physiology 121, 1247-1255.
10.1104/pp.121.4.124710594111PMC59491Lewis E and Wallace D. 1998. Program Development for CO
2 system calculations. Environmental System Science Data Infrastructure for a Virtual Ecosystem.
Lichtenthaler H, Wellburn A. 1983. Determinations of total carotenoids and chlorophylls
a and
b of leaf extracts in different solvents. Biochemical Society Transactions 11, 591-592.
10.1042/bst0110591Machalek KM, Davison IR and Falkowski PG. 1996. Thermal acclimation and photoacclimation of photosynthesis in the brown alga
Laminaria saccharina. Plant Cell Environment 19, 1005-1016.
10.1111/j.1365-3040.1996.tb00207.xMclachlan J and Bird CJ. 1986.
Gracilaria (Gigartinales, Rhodophyta) and productivity. Aquatic Botany 26, 27-49.
10.1016/0304-3770(86)90004-5Mercado JM, Javier F, Gordillo L, Niell X and Figueroa FL. 1999. Effects of different levels of CO
2 on photosynthesis and cell components of the red alga
Porphyra leucosticte. Journal of Applied Phycology 11, 455-461.
10.1023/A:1008194223558Millero FJ, Graham TB, Huang F, Bustos-Serrano H and Pierrot D. 2006. Dissociation constants of carbonic acid in seawater as a function of salinity and temperature. Marine Chemistry 100, 80-94.
10.1016/j.marchem.2005.12.001Ministry of Maritime Affairs and Fisheries (MOF). 2013. Standard method of marine environment process test.
Moreira D and Pires JC. 2016. Atmospheric CO
2 capture by algae: negative carbon dioxide emission path. Bioresource Technology 215, 371-379.
10.1016/j.biortech.2016.03.06027005790Nelson WA. 2009. Calcified macroalgae-critical to coastal ecosystems and vulnerable to chage: a review. Marine and Freshwater Research 60(8), 787-801.
10.1071/MF08335Nikinmaa M. 2014. An Introduction to Aquatic Toxicology (1st edition ed.). Elsevier: Academic Press.
10.1016/B978-0-12-411574-3.00001-3Olischläger M and Wiencke C. 2013. Ocean acidification alleviates low temperature effects on growth and photosynthesis of the red alga
Neosiphonia harveyi (Rhodophyta). Journal of Experimental Botany 64(18), 5587-5597.
10.1093/jxb/ert32924127518Samanta P, Jang S, Shin S and Kim JK. 2019. Effects of pH on growth and biochemical responses in
Agarophyton vermiculophyllum under different temperature conditions. Journal of Applied Phycology 1-11.
10.1007/s10811-019-01933-3Smit AJ. 2002. Nitrogen uptake by Gracilaria gracilis(Rhodophyta): adaptations to a temporally variable nitrogen environment. Botanica Marina 45, 196-209.
10.1515/BOT.2002.019Suárez-Álvarez S, Gómez-Pinchetti JL and García-Reina G. 2012. Effects of increased CO
2 levels on growth, photosynthesis, ammonium uptake and cell composition in the macroalga
Hypnea spinella (Gigartinales, Rhodophyta). Journal of Applied Phycology 24, 815-823.
10.1007/s10811-011-9700-5Xu Z, Zou D and Gao K. 2010. Effects of elevated CO
2 and phosphorus supply on growth, photosynthesis and nutrient uptake in the marine macroalga
Gracilaria lemaneiformis (Rhodophyta). Botanica Marina 53(2), 123-129.
10.1515/BOT.2010.012Zeebe RE, Zachos JC, Caldeira K and Tyrrell T. 2008. Carbon emission and acidification. Science 321, 51-52.
10.1126/science.115912418599765Zou D and Gao K. 2013. Thermal acclimation of respiration and photosynthesis in the marine macroalga
Gracilaria lemaneiformis (Gracilariales, Rhodophyta). Journal of Phycology 49(1), 61-68.
10.1111/jpy.1200927008389