Copyright © 2024 The Korean Society of Phycology
ABSTRACT
1. 서론
2. 재료 및 방법
2.1 마비성패독
2.2 시험생물 및 배양시약
2.3 Bioluminescence inhibition assay (BIA) 최적환경요인 설정
2.4 Bioluminescence inhibition assay (BIA)를 이용한 독성평가
2.5 독성값 산출
3. 결과 및 고찰
3.1 BIA 최적환경 요인 설정
3.2 STX군 대상 BIA 독성평가
3.3 BIA의 마비성패독 독성평가 적용 가능성 평가
4. 결론
1. 서론
전 세계적으로 기후변화에 따른 해양환경 변화가 발생하여 마비성패독 관련 유해플랑크톤이 대량으로 발생하는 사례가 보고되고 있다(Anderson et al. 2012; Nam and Oh 2021). 유해플랑크톤은 온도, 염과 같은 요소들에 독소 생산량이 영향을 받는 것으로 알려져 있는데, 온대해역에서는 담치류, 굴, 가리비, 바지락 등이 독소를 가진 조류를 섭식하여 유독화되는 독화기작을 가진다(Anderson 1997). 우리나라 해역에서는 진주담치(홍합), 굴, 피조개, 바지락 등 조개류와 피낭류인 미더덕에서 마비성패독이 검출되는데, 독화된 생물은 구분이 어렵고 마비성패독은 무색무취이며 열에 안정적이어서 냉동이나 조리과정에서도 파괴되지 않는 특징을 가지고 있다(Lee et al. 2020).
한국에서도 연안환경의 변화로 마비성패독 원인 플랑크톤의 출현 빈도와 기간이 증가하고 있고, 그 원인종에 대한 생리, 생태 연구가 활발하게 이루어지고 있다(Shin et al. 2017; Shin et al. 2021). NIFS (2011)의 연구 결과에 따르면, 한국 연안에서 마비성 패독은 와편모조류 Alexandrium catenella (Group I) (=A. tamarense)가 주 원인 생물로 보고되며, 이 와편모조류를 다량으로 섭식한 이매패류에 독소가 농축된다. 한국의 마비성패독 중독 최초 공식 보고는 1986년 4월에 진주담치로 인한 집단 중독사례이며, 이후 국립수산과학원에서 매년 모니터링을 진행하여 4-5월에 집중적으로 기준치를 초과하여 검출되는 것으로 보고되고 있다(NIFS 2024).
STX군 독소는 수용성인 Tetrahydropurine 구조를 바탕으로 한 화합물이며, 단일 물질이 아닌 전 세계적으로 30개 이상의 이성질체가 확인되었다(Song et al. 2013). 이성질체들은 독소별 독성 차이가 있으며, 체내에서 생화학적 변환에 의해 독성의 변화가 일어나기도 한다(Schantz et al. 1975). Association of Official Analytical Chemists (AOAC 959.08) 에 따르면 현재 마비성패독 검출 및 분석은 동물시험법인 Mouse bioassay (MBA)를 표준 분석법으로 규정하고 있다. MBA 시험법의 과정은 균질시킨 수산물 검체를 추출하고, 마우스 복강내 주사 후 치사하는 시간을 측정하여 Mouse Unit (MU)를 산출한다. 1 MU는 20 g의 mouse를 15분만에 사망하게 하는 독성값을 의미하며 STX 0.18 mg을 주사한 것과 동일한 것으로 보고되었다(Egmond 2004). MBA의 검출한계는 STX의 당량을 계산하여 치환한 값으로 약 40 μgSTXeq/패류 100 g이고, 전세계적으로 400 MU/패류 100 g을 기준치로 사용하고 있다(Schantz 1985). 우리나라를 포함한 대부분의 국가에서 마비성패독 검출을 위해 MBA 시험법을 표준분석법으로 규제를 하고 있지만 정확도 및 재현성이 떨어지는 문제와 동물윤리에 대한 사회적 이슈로 대체시험법 연구가 많이 수행되고 있다(David and Nicholson 2004; Jellett et al. 2002; Louzao et al. 2003).
대체시험법으로는 질량분석법인 LC-MS가 있으며, MBA 대비 5배의 감도를 가져 높은 성능의 검출한계와 정확도를 가지지만 표준시료가 없으면 검출이 불가능하다는 단점을 가지고 있다(Quilliam et al. 1989). 또한 세포 기반 실험법인 Neuro-2a assay (N2A)도 제안되었는데, MBA 보다 민감한 결과를 나타내고 분석의 속도와 편의성을 가지는 장점이 있다(Jellett et al. 1992). N2A는 MBA 시험법과 상관계수로 0.96 이상으로 높게 나타나는 것으로 알려져 있지만, 마비성패독 검출을 위한 표준 시험법 연구가 필요하다(Aballay-Gonzalez et al. 2016; Viallon et al. 2020).
발광박테리아 Aliivibrio fischeri는 빛을 발산하는 해양 기원 박테리아로 발광을 이용하는 여러 연구는 물론 생물검정시험의 시험종으로도 널리 이용되고 있는 생물이다(Fulladosa et al. 2005; Marugán et al. 2012). 발광박테리아의 발광은 luciferase 효소에 의하여 촉진된다(Bolelli et al. 2016). 발광작용은 집단-의존(quorum sensing)기전으로 박테리아가 자기유도물질을 생산하여 방출하고 자기유도물질은 유전자를 발현시켜 세포집단 밀도를 급격히 증가시켜 발광을 촉진시키는 작용이다(Scheerer et al. 2006; Shukla et al. 2020). 발광박테리아를 사용하는 Bioluminescence inhibition assay (BIA) 시험법의 원리는 독소 또는 환경시료를 처리하고 발광량의 감소 정도 측정한다. 처리한 시료의 독성 유무와 상대적 강도는 대조구와 비교하여 EC50 (Effect concentration 50%)과 같은 독성 지수를 산출하여 판별한다. 마비성패독을 대상으로 BIA를 적용한 연구도 수행된 바 있는데, Blaghen and Abakar (2019)에 따르면 세 가지 지역의 패류에서 BIA를 사용한 마비성패독 검출결과가 LC-MS의 결과와 상관관계가 0.97로 매우 유사한 결과가 보였고, Turrell et al. (2007)에 따르면 마비성패독 검출에 BIA를 적용할 경우 실험용 쥐 사용이 30~60% 감소한다고 보고되었다. BIA 시험법은 신속하고 한번에 많은 시료를 처리가 가능하며, 표준독소의 유무와 상관없이 진행할 수 있어 LC-MS 대비 경제적인 장점을 가진다(Girotti et al. 2002; Jennings et al. 2001).
본 연구는 해양 기원의 발광박테리아인 A. fischeri의 발광저해율을 측정하는 BIA 시험법을 마비성패독에 적용하기 위한 시험법을 표준화하여 MBA 대체시험법으로써 활용 가능성을 평가하고자 한다.
2. 재료 및 방법
2.1 마비성패독
STX군 독소 10종은 모두 표준물질(NRC; National Research Council Canada, CRM; Certified reference materials)을 구입하여 발광박테리아를 이용한 독성평가방법에 적용하였다. 독소의 보관은 STX은 4℃에서 다른 독소들은 -20℃에서 보관하여 실험하기 직전에 해동하여 사용하였다(Table 1).
Table 1.
The list of PSP (STX group) for toxic assessment.
|
STX group
|
Certified reference materials
|
|
STX
|
STX-g (NRC, CRM)
|
|
GTX1&4
|
GTX1&4-d (NRC, CRM)
|
|
GTX2&3
|
GTX2&3-d (NRC, CRM)
|
|
NEO
|
NEO-d (NRC, CRM)
|
|
dcNEO
|
dcNEO-d (NRC, CRM)
|
|
dcSTX
|
dcSTX-c (NRC, CRM)
|
|
dcGTX2&3
|
dcGTX2&3-c (NRC, CRM)
|
|
C1&C2
|
C1&C2 (NRC, CRM)
|
|
GTX5
|
GTX5-d (NRC, CRM)
|
|
GTX6
|
GTX6-b (NRC, CRM)
|
2.2 시험생물 및 배양시약
본 연구에서 사용한 시험생물과 배양시약은 국내 기술로 개발된 N-tox® (NeoEnBiz Co.)에 적합한 조건하에 사용되었다. 발광박테리아(Vibrio fischeri, NRRL B-11177)는 ㈜네오엔비즈 환경연구소에서 배양하여 동결 건조시킨 발광박테리아 시약(VF100®, NeoEnBiz Co.)과 활성화 시약(RS100®, NeoEnBiz Co.), 담수용 희석용액(DW100®, NeoEnBiz Co.)을 사용하여 실험을 수행하였다. 실험의 신뢰성 확보를 위하여 표준독성물질 황산아연(Zinc Sulfate, ZnSO4·7H2O)을 양성대조군으로 추가하였다.
2.3 Bioluminescence inhibition assay (BIA) 최적환경요인 설정
독성평가 대상인 STX군 표준물질은 HCl 용매에 용해되어 pH가 3.5로 pH에 의한 발광 저해가 나타나는지 확인하기 위하여 pH와 온도에 따른 선행연구를 수행하였다. pH는 2% NaCl 용액에 0.1, 1 N 농도의 HCl, NaOH 용액을 이용하여 조절하여 제조하였고, 발광 값은 pH를 1~13로 단계로 처리하였고, 온도는 STX의 보관온도 4℃와 실온 25℃를 비교하기 위하여 설정하고, 처리시간 0, 15, 30분 조건으로 설정하여 발광값을 측정하였다. 발광값들은 대조군을 기준으로 상대발광률을 산출하였다. 또한 시험법의 적합성을 확인하기 위하여 Zn test를 표준독성평가로 함께 수행하였다.
2.4 Bioluminescence inhibition assay (BIA)를 이용한 독성평가
BIA를 이용한 독성평가는 발광박테리아에 독소를 노출시키고 하여 각 독소에 따른 발광저해율을 관찰하였다. 발광박테리아는 96-well plate에 접종하였으며, 발광률은 N-tox® (NeoEnBiz Co.) 기기를 사용하여 측정하였다. 세부 시험조건은 Table 2와 같이 진행되었다. 관찰된 발광저해율로 용량-반응 그래프를 그리고, Toxcalc 소프트웨어를 사용하여 EC50값을 산출하였다.
2.5 독성값 산출
STX군 독소의 이성질체에 대한 정보와 체내 생물변환기작이 충분하지 않으므로, 추출물 내 독소의 총 독성을 추정할 수 있도록 이성질체의 상대적인 독성값인 독성등가계수(TEF)를 규정하여야 한다. EC50값에 근거하여 식 (1)에 따라 STX 독성값을 1로 규정하고 나머지 독소들의 상대독성값을 산출하였다. 산출한 TEF값은 WHO 및 EFSA에서 제시한 TEF값과 비교하여 독성평가법으로서의 활용 가능성을 타진하였다(EFSA 2009; WHO 2016).
3. 결과 및 고찰
3.1 BIA 최적환경 요인 설정
BIA 최적환경 요인 설정은 온도 및 pH에 따른 발광값으로 하였다. 두 가지 온도 조건(4℃, 25℃)에 pH를 1~14까지 처리하였고, 박테리아 활성용액(RS100®, NeoEnBiz Co.)과 담수 희석용액(DW100®, NeoEnBiz Co.)을 혼합시킨 실험구의 발광률을 대조구로 하였다. 두 가지 온도조건에서 pH에 따른 발광률은 대조구와 비교하여 상대발광률로 나타내었고, pH 3 조건을 비교하면 4℃는 상대발광률이 27.6%까지 감소하지만 25℃에서는 93.0%로 나타났다(Fig. 1). 즉, BIA 시험법의 상대오차율은 10%로 25℃에서 pH 3~10까지 적합한 결과값으로 평가된다.

Fig. 1
BIA optimization experiment results according to pH and temperature conditions.
최적환경요인으로 설정한 BIA 시험법을 수행한 결과, Zinc test의 EC50값이 2.9 mg/L로 나타났다(Fig. 2). 이는 표준독성평가의 적합한 범위 값(2.7~5.4 mg/L)으로 확인된다(Lee et al. 2008). 따라서, 설정한 시험법이 BIA 시험법으로 적합한 것으로 평가된다.
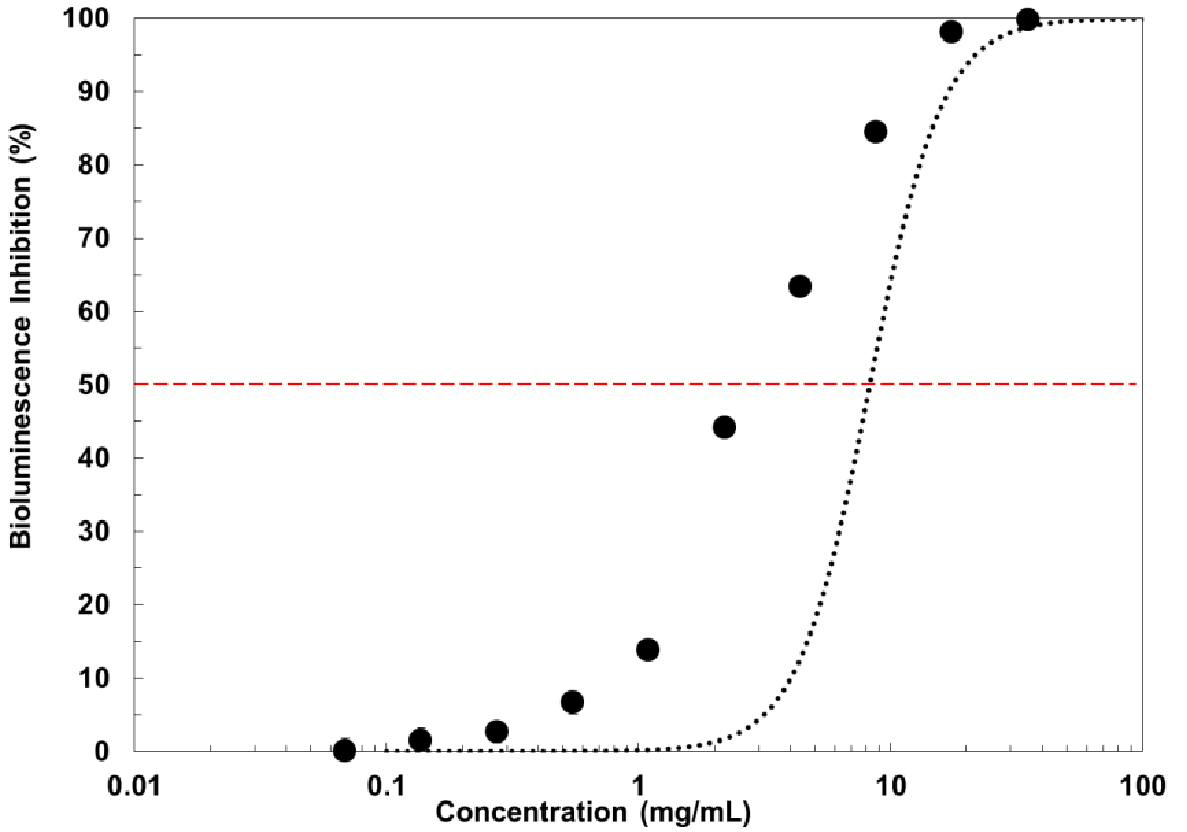
Fig. 2
Standard toxicity assessment (Zn test) results.
BIA 최적환경 요인 설정 실험을 통하여 BIA의 노출조건, 온도, 측정 기기 등 세부 실험조건 확립하였다. 먼저 노출조건은 시험용액을 100%로 30분간 노출하였고, 온도는 20~25℃를 유지하고 N-tox 200 (NeoEnBiz Co.) 기기를 통하여 발광저해율을 측정하였다(Table 2).
Table 2.
Method for Bioluminescence inhibition assay.
|
Parameter
|
Condition
|
|
Specie (strain)
| Aliivibrio fischeri (NRRL B-11177)
|
|
Exposure concentration
|
100%
|
|
Exposure time
|
30 min
|
|
Temperature
|
20~25℃
|
|
Bacteria and sample injection amount
|
100 μL
|
|
Measure instrument
|
N-tox 200 (NeoEnBiz Co.)
|
|
Diluting solution
|
2% NaCl solution
|
|
Positive control
|
ZnSO4·7H2O
|
|
End point
|
Luminescence inhibition rate (%)
|
3.2 STX군 대상 BIA 독성평가
BIA를 활용한 STX군 독소 10종에 대한 독성평가는 독소에 따른 발광저해율을 용량-반응 그래프로 나타내고, EC50값을 확인하였다(Fig. 3). 발광저해율은 모든 독소에서 노출 농도와 시간에 비례하여 중가하는 것으로 나타났다. STX의 EC50값은 20.9 mg/L로 관찰되었고 GTX1&4, GTX2&3, dcGTX2&3, C1&C2, GTX5는 STX보다 낮은 독성값을 보였는데, GTX 2&3이 72.1 mg/L로 가장 낮은 독성을 나타냈다. NEO, dcNEO, dcSTX, GTX6는 STX보다 높은 독성값을 보였으며, 그 중 GTX6가 6.3 mg/L로 가장 높은 독성값으로 확인되었다. 이처럼 BIA 시험법은 STX군의 독소에 따라 농도 의존적인 발광저해율 차이가 나타나 독성의 유무와 각 독소가 가진 상대적 독성을 파악할 수 있으므로 MBA 대체시험법으로서 가능성을 확인하였다.
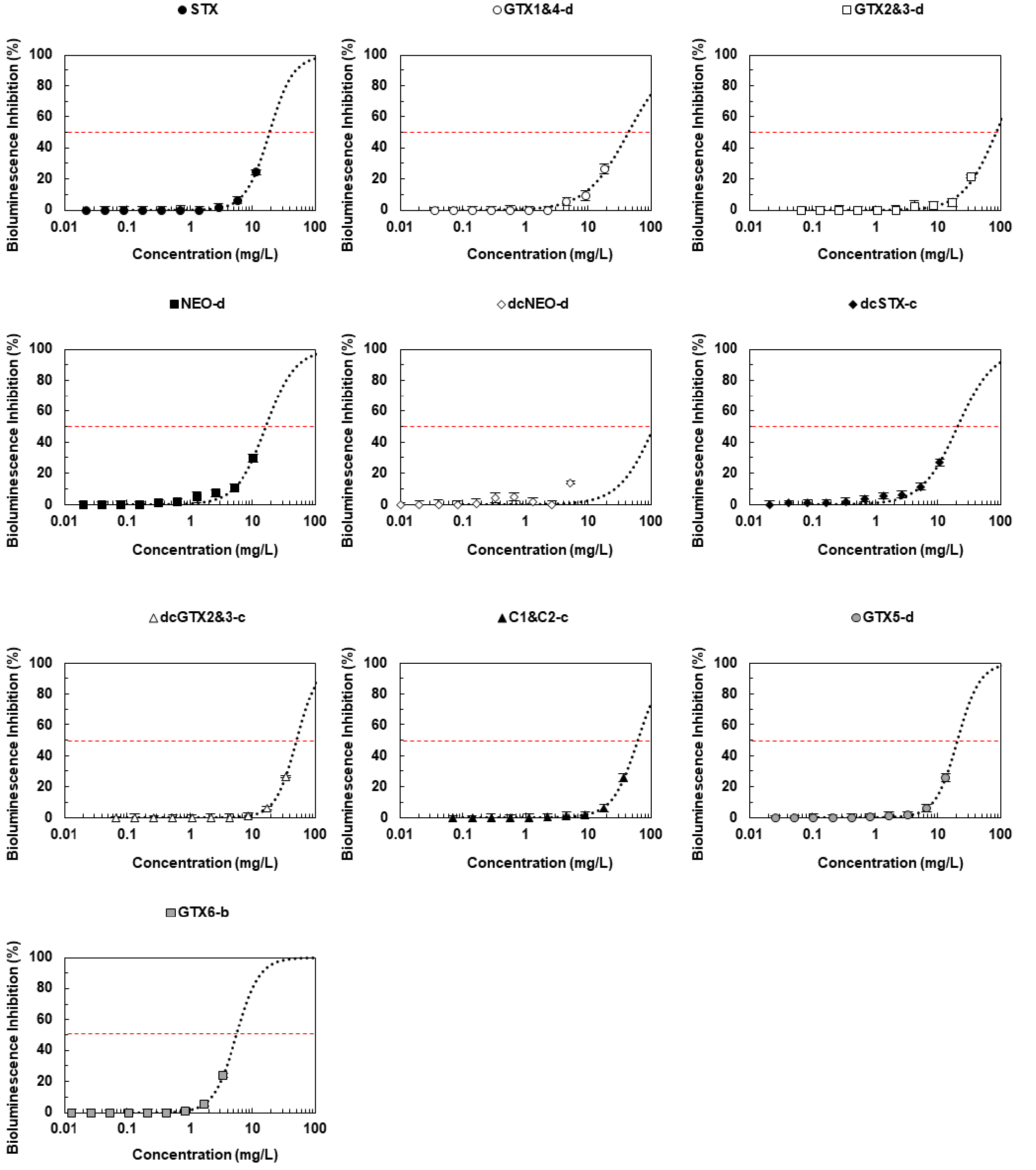
Fig. 3
BIA application toxicity evaluation dose-response graph for the STX group.
3.3 BIA의 마비성패독 독성평가 적용 가능성 평가
STX군 독소 10종을 대상으로 BIA를 적용하여 독성평가를 수행한 결과, GTX1&4, GTX2&3, dcGTX2&3와 같은 일부 독소의 TEF값은 WHO (2016) 및 EFSA (2009)에서 STX군 독소의 체내 기작 및 MBA 결과를 토대로 제시한 TEF값과 유사한 값을 보였지만, NEO, dcNEO, dcSTX 등 대부분의 독소에서 EFSA (2009)와 WHO (2016) TEF값과 차이가 나타났다(Table 3). 특히 GTX6의 TEF값은 EFSA (2009)와 WHO (2016)에서 각각 0.05, 0.10으로 가장 낮게 나타났지만, BIA에서는 3.32로 가장 높은 TEF값이 확인되었다. 기존 마비성패독을 대상으로 독성평가를 수행한 연구는 신경세포의 나트륨 채널을 이용한 실험 결과를 바탕으로 산출한 것으로(EFSA 2009), BIA 시험법을 적용하기 앞서 발광박테리아의 대사활동 및 생리활성 등의 마비성패독을 대상으로 특이성을 확인할 수 있는 추가 연구가 필요할 것으로 사료된다.
Table 3.
Comparison of STX group toxin TEF values.
|
STX group
|
EC50 (mg/L)
|
TEF (BIA result)
|
TEF (WHO 2016) |
TEF (EFSA 2009)
|
|
STX
|
20.9
|
1.00
|
1.00
|
1.00
|
|
GTX1&4
|
33.5
|
0.62
|
0.85
|
0.85
|
|
GTX2&3
|
72.1
|
0.29
|
0.50
|
0.50
|
|
NEO
|
17.2
|
1.22
|
2.00
|
1.00
|
|
dcNEO
|
16.4
|
1.27
|
0.20
|
0.40
|
|
dcSTX
|
19.7
|
1.06
|
0.50
|
1.00
|
|
dcGTX2&3
|
58.3
|
0.36
|
0.30
|
0.30
|
|
C1&C2
|
63.4
|
0.33
|
0.06
|
0.05
|
|
GTX5
|
23.5
|
0.89
|
0.10
|
0.10
|
|
GTX6
|
6.3
|
3.32
|
0.05
|
0.10
|
4. 결론
발광박테리아를 활용한 BIA 시험법은 환경독성 분야에서 널리 이용되고 있다. 신속하고 다량의 시료를 한번에 처리할 수 있는 장점이 있지만 특정 독소에 대한 반응기작을 측정하는 것에는 어려움이 있다. STX군 표준품에 대한 독성평가를 수행한 결과 독소에 따른 독성값은 상이하였지만, 기존의 EFSA (2009) 및 WHO (2016) 등에서 제시한 TEF값과 다르게 확인되었고 BIA 시험법의 마비성패독에 대한 특이성이 제시되지 않아 대체시험법으로써 활용에 어려움이 있는 것으로 사료된다. 이번 연구 결과는 마비성패독 검출을 위한 대체 시험법으로 BIA의 타당성을 평가하는 기초 자료로 활용될 것으로 기대된다.
Acknowledgements
본 연구는 2024년도 식품의약품안전처의 연구개발비(20163MFDSS641)로 수행되었으며 이에 감사드립니다.
References
Aballay-Gonzalez A, Ulloa V, Rivera A, Hernández V, Silva M, Caprile T, Delgado-Rivera L and Astuya A. 2016. Matrix effects on a cell-based assay used for the detection of paralytic shellfish toxins in bivalve shellfish samples. Food Additives & Contaminants: Part A 33, 869-875.
10.1080/19440049.2016.116674127002718Anderson DM. 1997. Turning back the harmful red tide. Nature 388, 513-514.
10.1038/41415Anderson DM, Alpermann TJ, Cembella AD, Collos Y, Masseret E and Montresor M. 2012. The globally distributed genus Alexandrium: multifaceted roles in marine ecosystems and impacts on human health. Harmful Algae 14, 10-35.
10.1016/j.hal.2011.10.01222308102PMC3269821Blaghen M and Abakar Ah. A. 2019. Bioluminescence of Vibrio fischeri: A novel application for PSP quantification. Journal of Applied Biology and Biotechnology 7, 60-64.
10.7324/JABB.2019.70111Bolelli L, Ferri EN and Girotti S. 2016. The management and exploitation of naturally light-emitting bacteria as a flexible analytical tool: A tutorial. Analytica Chimica Acta 934, 22-35.
10.1016/j.aca.2016.05.03827506340David LS and Nicholson RA. 2004. Quantitation of paralytic shellfish toxins using mouse brain synaptoneurosomes. Chemosphere 55, 1315-1321.
10.1016/j.chemosphere.2003.10.05615081774EFSA. 2009. Marine biotoxins in shellfish-Saxitoxin group. EFSA Journal 7, 1019.
10.2903/j.efsa.2009.1019Egmond HP. 2004. Marine biotoxins 80. Food & Agriculture Org.
Fulladosa E, Murat J, Martínez M and Villaescusa I. 2005. Patterns of metals and arsenic poisoning in Vibrio fischeri bacteria. Chemosphere 60, 43-48.
10.1016/j.chemosphere.2004.12.02615910900Girotti S, Bolelli L, Roda A, Gentilomi G and Musiani M. 2002. Improved detection of toxic chemicals using bioluminescent bacteria. Analytica Chimica Acta 471, 113-120.
10.1016/S0003-2670(02)00870-XJellett JF, Marks LJ, Stewart JE, Dorey ML, Watson-Wright W and Lawrence JF. 1992. Paralytic shellfish poison (saxitoxin family) bioassays: automated endpoint determination and standardization of the in vitro tissue culture bioassay, and comparison with the standard mouse bioassay. Toxicon 30, 1143-1156.
10.1016/0041-0101(92)90430-D1440621Jellett JF, Roberts RL, Laycock MV, Quilliam MA and Barrett RE. 2002. Detection of paralytic shellfish poisoning (PSP) toxins in shellfish tissue using MIST AlertTM, a new rapid test, in parallel with the regulatory AOAC® mouse bioassay. Toxicon 40, 1407-1425.
10.1016/S0041-0101(02)00153-812368111Jennings VL, Rayner-Brandes MH and Bird DJ. 2001. Assessing chemical toxicity with the bioluminescent photobacterium (Vibrio fischeri): a comparison of three commercial systems. Water Research 35, 3448-3456.
10.1016/S0043-1354(01)00067-711547867Lee KT, Park GS and Kim PJ. 2008. Development of marine toxicity standard method for marine luminescent bacteria: Introduction of n-tox test. The Sea 13, 156-163.
Lee SY, Im JH, Woo SY, Choi HY, Park SB, Yoo CN and Chun HS. 2020. Saxitoxin and Its Analogues: Toxicity, Analytical Method, Occurrence and Safety Management. Journal of Food Hygiene and Safety 35, 521-534.
10.13103/JFHS.2020.35.6.521Louzao MC, Vieytes MR, Cabado AG, Vieites Baptista de Sousa JM and Botana LM. 2003. A fluorimetric microplate assay for detection and quantitation of toxins causing paralytic shellfish poisoning. Chemical Research in Toxicology 16, 433-438.
10.1021/tx025574r12703959Marugán J, Bru D, Pablos C and Catalá M. 2012. Comparative evaluation of acute toxicity by Vibrio fischeri and fern spore based bioassays in the follow-up of toxic chemicals degradation by photocatalysis. Journal of Hazardous Materials 213, 117-122.
10.1016/j.jhazmat.2012.01.07522341980Nam KT and Oh SJ. 2021. Influence of water temperature and salinity on the production of paralytic shellfish poisoning by toxic dinoflagellate Alexandrium catenella (Group I). Journal of the Korean Society of Marine Environment & Safety 27, 119-126.
10.7837/kosomes.2021.27.1.119NIFS. 2011. Improvement of Analysis Method for Paralytic Shellfish Poisoning Toxin.
Quilliam MA, Thomson BA, Scott GJ and Siu KM. 1989. Ion‐spray mass spectrometry of marine neurotoxins. Rapid Communications in Mass Spectrometry 3, 145-150.
10.1002/rcm.12900305082520236Schantz E. 1985. Purified shellfish poison for bioassay standardization. Conference on Shellfish Toxicology 1957.
Schantz EJ, Ghazarossian VE, Schnoes HK, Strong FM, Springer JP, Pezzanite JO, and Clardy J. 1975. Structure of saxitoxin. Journal of the American Chemical Society 97(5), 1238-1239.
10.1021/ja00838a0451133383Scheerer S, Gomez F and Lloyd D. 2006. Bioluminescence of Vibrio fischeri in continuous culture: Optimal conditions for stability and intensity of photoemission. Journal of Microbiological Methods 67, 321-329.
10.1016/j.mimet.2006.04.01016750278Shin HH, Li Z, Kim ES, Park JW and Lim WA. 2017. Which species, Alexandrium catenella (Group I) or A. pacificum (Group IV), is really responsible for past paralytic shellfish poisoning outbreaks in Jinhae-Masan Bay, Korea? Harmful Algae 68, 31-39.
10.1016/j.hal.2017.07.00628962988Shin HH, Li Z, Kim HJ, Park BS, Lee J, Shin AY, Park TG, Lee KW, Han KH and Youn JY. 2021. Alexandrium catenella (Group I) and A. pacificum (Group IV) cyst germination, distribution, and toxicity in Jinhae-Masan Bay, Korea. Harmful Algae 110, 102-122.
10.1016/j.hal.2021.10212234887002Shukla DM, Bajwa V, Gajic D and Saxena PK. 2020. Quorum sensing inhibition in Vibrio fischeri: an efficient system to assess antibacterial properties of medicinal plants and their volatile compounds. Integr. Food Nutr. Metab. 7, 1-9.
10.15761/IFNM.1000281Song KC, Lee KJ, Yu HS, Mok JS, Kim JH, Lim KS and Lee MA. 2013. Paralytic Shellfish Poisoning (PSP) analysis using liquid chromatography-tandem mass spectrometry. Korean Journal of Fisheries and Aquatic Sciences 46, 154-159.
10.5657/KFAS.2013.0154Turrell E, Lacaze J and Stobo L. 2007. Determination of paralytic shellfish poisoning (PSP) toxins in UK shellfish. Harmful Algae 6, 438-448.
10.1016/j.hal.2006.12.002Viallon J, Chinain M and Darius HT. 2020. Revisiting the neuroblastoma cell-based assay (CBA-N2a) for the improved detection of marine toxins active on voltage gated sodium channels (VGSCs). Toxins 12, 281.
10.3390/toxins1205028132349302PMC7290318WHO. 2016. Toxicity equivalence factors for marine biotoxins associated with bivalve molluscs.