1. 서론
고퇴적물은 호수의 역사를 재구성하는 수단으로 저서 퇴적물은 미생물 다양성을 포함하여 과거 수생태계의 증거를 저장하는 것으로 알려져 있다(Domaizon et al. 2013; Martinez De La Escalera et al. 2014; Savichtcheva et al. 2015). 고생물학에서 얻은 회귀 관찰을 통해 개체군의 장기적인 동태학을 재구성하고 호수의 배경 상태와 티핑 포인트(tipping point)를 확인 할 수 있으며(Kaplan-levy et al. 2010), 이를 위한 고퇴적물에서 장기적인 동태학을 추적하는데 사용되는 주요 방법 중 하나는 화석(동정 할 수 있는 경우)을 이용하는 방법이다(Capo et al. 2015). 하지만 담수의 저층 퇴적물은 상대적으로 지구환경 변화 자료를 연속적으로 잘 보존하는 해양퇴적물에 비해 전 세계적으로 육상의 호수 퇴적물에 대한 연구는 많이 진행되지는 않았다(Cheong and Kim 2008). 그 이유는 과거 지구환경 변화의 기록을 양호하게 잘 보존하고 있는 육성퇴적물의 분포가 전 세계적으로 극히 제한되어 있으며, 기술적으로 퇴적물 시추를 통해 양호한 심부 퇴적층의 획득이 용이하지 않았기 때문이다. 다만 몇몇 선진국 학자들이 중심이 되어 지난 20년 동안 대규모 육성 호수 퇴적물을 이용한 고기후의 변동에 대한 연구는 꾸준히 진행해 오고 있다(Cheong and Kim 2008; Nam and Kim 2011).
염주말목(Nostocale)에 속하는 유해 남조류의 생활사는 부유성인 영양세포(vegetative cells)와 저서성인 휴면포자(akinete) 단계로 나뉘며(Suikkanen et al. 2010), 휴면포자 단계는 일시적인 휴면상태로써, 성장환경이 좋아지면 발아하여 영양세포로 발달하므로 영양세포 발생 메커니즘과 관련되어 매우 중요하다(Dale 1977; Collman 1983). 수체 내에서 남조류 영양세포 성장은 퇴적층의 휴면포자 발아에 의해 시작되며, 발아의 시기는 휴면포자가 분포하는 수체의 환경조건에 따라서 다르다(Takamura et al. 1984). 따라서 퇴적층과 수층이 연결된 생활사는 이 특별한 남조류의 생존을 위한 적응전략으로서 생태학적 중요성을 가지고 있다(Barbiero and Welch 1992). 이러한 남조류의 휴면포자 세포는 남조류 초기 발생에 중요한 “씨앗개체군(seed population)”으로 작용하기 때문에(Anderson and Walls 1978; Anderson and Keafer 1985; Bolch and Blackburn 1996), 퇴적층에서 휴면포자의 분포와 현존량을 파악하는 것은 대발생 원인 남조류의 생태와 발생을 이해하는데 필수적이다(Nehring 1996; Anderson et al. 2002).
염주말목(Nostocales) 및 스티고네마목(Stigonematales)을 포함한 특정 종은 고퇴적물에서 휴면포자가 발견된다고 알려져 있다. 휴면포자는 무산소, 건조 및 빛 부족과 같은 불리한 환경 조건에서 생존 할 수 있어 퇴적물에 존재하는 휴면포자는 과거 염주말목 남조류의 발생 기록으로 사용될 수 있다. 국외의 연구는 이미 고퇴적물에서 과거의 휴면포자 화석 분포를 조사했으며, 1950년동안(cal.yr BP)의 염주말목 남조류 동태학을 설명하였다. 고퇴적물에서 이러한 휴면포자를 포함한 휴면세포(resting cells)를 조사하면 생존 가능성과 소생 생태학(resurrection ecology)에 대한 아이디어를 조사 할 수 있다. Wood et al. (2009)는 120 BP 퇴적물에 존재하는 휴면포자를 발아시켜 휴면포자의 놀라운 생존력을 보고하였다. 또한 Legrand et al. (2017)는 코어를 사용하여 220년된 퇴적물에서 휴면포자의 생존력과 보존의 장기 지속성을 조사했다. 그러나 1세기 이상 거슬러 올라가는 퇴적물에 대한 다른 연구는 거의 존재하지 않아 장기 지속성에 관련된 추진 요인을 결정하는데 어려움이 있다. 이러한 맥락에서 과거 남조류 증식의 정량적 특성, 과거 독성 잠재력 및 퇴적물에서 장기간 생존 할 수 있는 능력에 대한 정보를 동시에 통합할 필요성에 본 연구와 같은 기초 연구가 반드시 수행되어야 한다.
일반적으로 휴면포자의 형태적 특징은 종을 분류함에 있어 중요한 핵심인자(key factor)로 간주된다. 지난 수십 년 동안 휴면 단계의 플랑크톤 형태(e.g. akinete, resting spore, cyst), 영양세포로의 발달 과정에 대해 많은 연구가 이루어졌음에도 불구하고, 기존 연구의 대부분은 해양 와편모조류의 휴면포자(cyst), 규조류의 휴면포자(spore)에 대한 분류, 분포 및 생리생태에 관해 집중되어 왔다(Kim and Han 2000; Pospelova and Kim 2010; Shin et al. 2017).
환경부 습지보호지역 및 경상북도 기념물로 지정되어 있는 공검지는 경북 상주시 공검면 양정리에 위치하고 있다. 문헌기록에 따르면 공검지는 둑길이 430 m, 둘레 8.68 km, 수심 5.6 m 로 추정된다고 보고된 바 있다(Lim et al. 2011). 공검지는 역사적으로 가장 오래된 3대 인공저수지 중의 하나로서 삼한시대에 축조된 것으로 전해지는 고대 저수지이다(DREO 2014). 공검지는 원삼국시대에 벼농사를 짓기 위해 축조된 농업용 저수지로 역사적 가치가 높아 제천 의림지, 김제 벽골제와 더불어 국내에서 가장 오래된 인공저수지 중의 하나이며 조선시대 3대 저수지로도 알려져 있다(Lim et al. 2011; DREO 2014). 이러한 역사적 중요성 이외에도 최근 연못과 습지로 복원된 공검지는 생태관광 자원화 측면에서 가치가 높아 매우 중요하게 인식됨에 따라 경상북도 지방기념물 및 습지보호구역으로 지정되어 보호되고 있어 그 중요성이 강조되고 있으며 역사적으로도 가치가 매우 높기 때문에 공검지의 축조 시기를 파악하기 위한 연구에서부터 공검지 주변 환경이나 수생태 환경에 관한 연구 등 다양한 연구가 진행되고 있다(Hwang et al. 2014; Kim et al. 2017). 특히, 국립낙동강생물자원관에서는 2016년부터 한반도 주요 습지의 고생물 및 고환경 연구를 수행해왔으며, 2016년에는 상주 공검지의 외부 4지점, 19년부터는 공검지 퇴적토 깊이별로 분포하는 돌말류의 지질 분석을 실시하여 최근에는 시대별 공검지 규모를 밝히기도 하였다(Lee et al. 2020).
따라서 본 연구는 호소 및 습지로 예상되는 공검지 지역 내 고퇴적물에서 염주말목(Nostocales) 남조류의 휴면포자(akinete)가 분포하는지 분석하여 과거 공검지 남조류 발생 기록을 확인하고 휴면포자 생태적 특징에 대한 문헌 연구를 조사하여 과거 공검지 기후에 대해 유추하고자 하였다.
2. 재료 및 방법
2.1 조사지점 및 퇴적물 채취(시추)
조사 지점은 상주에 위치한 공검지 일대(상주시 공검면 무곡리 895) 3개 지점에서 진행되었다(Fig. 1, Table 1). 현장에서의 시추는 공경이 NX 규격(75.4 mm)으로 회전 무수방식으로 시추를 하였으며, 시추 심도는 기반암 또는 기반암 풍화대가 출현하는 심도까지 시추를 실시하였고, 확보된 코어 샘플은 현장에서 진공 포장하였다. 시추가 완료된 1 m 단위의 파이프 코어를 nylon string을 이용하여 세로로 절반을 절단하였으며, 절단된 시료의 반은 분석용(퇴적상, 생물 및 지질)으로 사용하였으며, 연대분석을 위한 나머지 샘플은 진공 포장 및 라벨링하여 저온 보관을 실시하였다. 분석용 샘플은 실내로 가지고 온 뒤, 분무기와 솔 등을 사용하여 시료의 단면을 정리하였으며 이후, 10 cm 등간격으로 퇴적물 시료를 채취 후 유리 vial에 보관하였다.

Fig. 1
Location of the core sampled in the Gonggeomji wetland, South Korea.
Table 1.
Coordinate, elevations and the lengths of recovered core for each drilling sites.
|
Site
|
Coordinate
|
Location
|
Length of recovered core (m)
|
|
Site. 1
|
36°29'43.2"N
|
128°07'51.7"E
|
1189-6 Otae-ri, Gonggeom-myeon, Sangju-si, Gyeongsangbuk-do
|
10
|
|
Site. 2
|
36°30'31.7"N
|
28°08'42.3"E
|
940 Bugok-ri, Gonggeom-myeon, Sangju, Gyeongsangbuk-do
|
9
|
|
Site. 3
|
36°30'49.83"N
|
128°09'13.02"E
|
89, Bugok-ri, Gonggeom-myeon, Sangju-si, Gyeongsangbuk-do
|
6
|
2.2 퇴적물 연대 분석
퇴적층의 형성 시기를 분석하기 위하여 시추된 퇴적토에서 탄소연대 측정용 유기물(식물편 등)을 핀셋으로 채집하였다. 채집된 시료는 가속질량분석기(Accelerator mass spectrometer, AMS, 한국지질자원연구원)를 이용하여 방사성탄소(14C)를 통한 연대측정을 실시하였다. 방사성탄소연대측정을 위한 시료 중 퇴적물 시료는 휴믹산(Humic acid) 처리를 통해 흑연을 추출하였고, 목편은 산-염기-산(AAA) 화학처리를 통해 오염물을 제거한 후 분석용 흑연을 추출하였다. 본 연구에 적용된 모든 탄소 연대의 보정은 Oxcal v4.3 프로그램을 이용하였고 2σ 오차 범위(신뢰한계 95.4%)를 활용하였다.
2.3 퇴적물의 휴면포자 분리 및 형태적 특징 분석
퇴적층에 존재하는 남조류 휴면포자의 밀도를 측정하기 위해 공검지 퇴적층을 시추하였다. 시추된 퇴적물은 외부 공기와의 접촉을 최대한 차단 시키기 위하여 PVC관으로 옮긴 다음 현장에서 진공 포장을 실시하였다. 이후, 실험실로 운반된 퇴적물은 20 g을 미량저울(OHAUS CO., USA)로 측정하여 50 mL conical tube에 옮겨 담았다. 퇴적물을 옮겨담은 tube에 Ludox 시약(Ludox-HS 40, Sigma Aldrich) 을 50 mL까지 채워 넣은 후 교반하였다. 교반은 conical tube 내부의 퇴적물이 Ludox 시약에 완전히 풀어져 퇴적물 내에 휴면포자 세포가 Ludox 시약에 노출되도록 진행하였다. 교반이 완료된 샘플은 2,000 rpm에서 15분 동안 원심분리하여 퇴적물 입자와 휴면포자 세포를 층분리 하였다. 원심분리가 완료된 시료의 상등액을 20 μm sieve에 옮겨 담아 남조류 세포를 걸러냈다. 남조류 세포는 Ludox 시약을 제거하기 위해 3차 증류수로 세척하였으며, 최종적으로 휴면포자를 10 mL 3차 증류수에 농축하여 20 mL 갈색 vial에 옮겨 담았다. 남조류 세포는 1 mL를 Sedgwick-Rafter chamber (SR chamber)에 옮겨 담은 후 1,000개 칸을 모두 관찰하였다. 휴면포자의 형태적 특징을 분석하기 위하여 DIC 현미경(Differential Interference Contrast Microscopy) (Eclipse Ni, Nikon, Japan)에서 400배와 1,000배의 배율하에 휴면포자의 형태 및 크기를 검경하였으며, 출현한 모든 휴면포자에 대해 현미경용 디지털카메라(DS-Ri2, Nikon, Japan)로 사진촬영을 하였으며 세포의 장축과 단축의 길이는 innerview 2.0 (Innerview Co., Ltd, 2010, Korea) 프로그램을 이용하여 측정하였다. 또한 전자현미경으로 볼 수 없는 휴면포자의 초미세구조(외곽형태, 돌기)를 보기 위하여 전계방사형주사전자현미경(FE-SEM, MIR-3, Tescan, Czech)을 통해 휴면포자의 형태를 촬영하였다.
3. 결과
3.1 휴면포자의 형태적 특징
공검지 3개 지점에서 시추한 퇴적 샘플을 현미경을 통하여 관찰한 결과, 남조류 휴면포자는 두가지 형태가 관찰되었다. Type 1의 휴면포자는 전형적인 Dolichospermum (=Anabaena) 속의 휴면포자의 외관 형태인 타원형(elliptical)이나 계란형을 보였으며, 세포 내에 과립도 존재하는 것을 볼 수 있었다. 세포의 길이는 14 ~ 22 μm, 폭은 16 ~ 26 μm 범위를 보였다. 광학현미경을 통하여 보이는 휴면포자의 색은 밝은 녹색을 보였다(Fig. 2 a, b). 주사전자현미경을 통해 관찰한 결과, 세포 외부에 돌기가 있었으며 세포 말단 부분에는 작은 유두 모양의 돌기가 관찰되었다(Fig. 2 c, d). 공검지 퇴적층에서 가장 많이 출현한 type 2의 휴면포자의 외관 형태는 주로 긴 원통형(cylindrical type)의 외형으로써 길이는 45 ~ 90 μm, 폭은 4 ~ 8 μm 범위를 보였고, Aphanizomenon 휴면포자의 형태적 특징과 유사한 외관 형태를 보였다. 세포벽은 두껍게 형성되어 있었으며, 휴면포자의 말단 부분에는 영양세포로 보여지는 긴 사상체가 연결되어 있는 휴면포자와 영양세포가 보이지는 않으나 휴면포자의 세포벽이 길게 연결되어 있는 휴면포자 등 다양한 형태의 휴면포자가 관찰되었다. 세포벽 내 색깔은 연녹색을 띄었으며, 세포 내 녹색의 과립은 관찰할 수 없었다(Fig. 3 a, b). 전자현미경을 통하여 미세구조를 분석한 결과, 휴면포자를 둘러싸고 있는 세포벽은 관찰되지 않았으며 휴면포자 외관은 꽈배기처럼 꼬인 형태로 이루어져 있었고 긴 막대형을 보였다(Fig. 3 c, d).

Fig. 2
Images of type 1 akinete using light microscopy (LM) and scanning electron microscopy (SEM). (a, b) the akinete typical morphology on light microscopy, (c, d) appearance of the akinete through a scanning electron microscopy.

Fig. 3
Images of type 2 akinete using light microscopy (LM) and scanning electron microscopy (SEM) (a, b) the akinete typical morphology on light microscopy, (c, d) appearance of the akinete through a scanning electron microscopy.
3.2 퇴적층내 휴면포자 분포
공검지 퇴적토 깊이별(연대별) 남조류 휴면포자의 분포를 알아보기 위해 3개 지점에서 시추한 퇴적토 내 깊이에 따른 휴면포자 밀도를 파악하였다. 지점별 휴면포자 밀도 조사 결과, 지점 간의 시·공간적 분포 차이를 보였다. 현재의 공검지와 인접한 지점인 St. 1에서는 퇴적 중간층인 3.6 ~ 3.9 m, 4.6 m의 깊이에서만 남조류의 휴면포자가 발견되었으며, 발견된 휴면포자는 type 1 형태만 관찰되었다(Fig. 4). 출현 밀도는 3.6 ~ 3.7 m 구간에서 가장 많은 14 cells이 관찰되었으며, 4.5 ~ 4.6 m 구간에서 5 cells mL-1의 휴면포자가 관찰되었다. 탄소 연대 분석 결과, 3.6 ~ 3.9 m 구간은 1,500년대로 나타났으며, 4.6 m는 기원전 860년대로 나타났다(Fig. 4). 공검지와 오태저수지 사이 지점인 St. 2에서는 type 1, 2 형태의 휴면포자가 모두 관찰되었으며, 퇴적층별 출현 유무를 봤을 때, type 1의 휴면포자는 비교적 상층 구간인 1.1 ~ 3.0 m의 구간에서 출현하였으며, type 2의 휴면포자는 3.0 ~ 4.0 m의 중층 구간의 퇴적층에서 출현하였다(Fig. 4). St. 2에서 type 1의 휴면포자 개체수는 5 cells ml-1 이하를 보인 반면, type 2의 휴면포자 개체수는 250 ~ 300 cells mL-1가 출현하였다. 특히, 3.0 ~ 3.1 m (1,500년대) 구간의 퇴적층에서 type 2의 휴면포자가 318 cells mL-1이 출현하여 1 ml 당 가장 많은 휴면포자가 관찰된 것을 볼 수 있었으며, 다음으로는 3.7 ~ 3.8 m (630년대) 구간에서 type 2 형태의 휴면포자가 264 cells mL-1이 관찰되었다(Fig. 4). Type 2의 휴면포자 개체수가 많이 발견된 3.0 ~ 3.2 m 구간에서는 연대분석 결과 1,500년대로 나타났으며, 3.6 ~ 3.8 m구간에서는 630년대로 나타났다. 오태저수지 인근인 St. 3에서는 type 2의 휴면포자만 관찰되었으며, 개체수는 50 cells mL-1 이하로 출현하였고, 3.6 ~ 3.9 m, 4.5 ~ 4.7 m의 중층의 퇴적층에서 출현하였으며, 연대분석 결과 휴면포자가 발견된 지점 모두 기원전 1,800년대로 나타났다(Fig. 4).

Fig. 4
Distribution of two types akinete in the different sediment depth in Gonggeomji.
3.3 두가지 타입 휴면포자의 형태적 특징과 비교
공검지에서 출현한 2종류의 휴면포자(type 1, 2)에 대하여 길이와 폭을 측정한 결과(type 1 (n=29), type 2 (n=300)), type 1의 휴면포자는 다른 남조류 속(Dolichospermum, Cylindrspermopsis, Aphanizomenon)의 휴면포자들의 길이와와 폭의 범위에 모두 속하였으며(Park et al. 2018), 특히, type 1의 휴면포자는Dolichospermum 속의 휴면포자의 길이 및 폭과 큰 차이가 없는 것을 확인할 수 있었다(Fig. 5). Type 2의 휴면포자는 3속의 휴면포자의 길이와 폭을 비교 했을 때, 폭은 상대적으로 2배 이상 짧았고, 길이는 2 ~ 4배 이상 긴 것을 확인 할 수 있었으며, Aphanizomenon속의 휴면포자와 일부분 겹치는 것을 확인 할 수 있었다(Fig. 5). 종합적으로 속(genus) 수준에서 휴면포자의 크기는 뚜렷한 차이를 보였으며, 동일 종 내에서도 서로 다른 지역의 변종에서 형성된 휴면포자는 약간의 세포 크기 차이가 존재하였다(Fig. 5). Type 1 휴면포자는 비교대상인 Dolichospermum속의 휴면포자와, type 2 휴면포자는 Aphanizomenon 속 휴면포자의 길이와 폭의 비율이 비슷한 결과를 보였다. Type 1 휴면포자는 장폭 비가 평균 1.8 (length: 20.8 μm, width: 13.1 μm)이었으며 종 수준(Dolichospermum: 평균 1.7 ratio)에서 큰 차이가 없었다. 하지만 Aphanizomenon과 Cylindrospermopsis는 평균 장폭 비가 각각 4.1 (length: 23.9 μm, width: 6.4 μm), 3.7 (length: 12.2 μm, width: 3.6 μm)로서 Aphanizomenon과 Cylindrospermopsis는 모두 길이(length)가 폭(width)보다 3 ~ 4배 긴 형태의 원통형을 나타내었으며, Dolichospermum의 평균 비(ratio)보다 큰 것으로 나타났다. 따라서 같은 염주말목의 휴면포자라 할지라도 형태학적 특징은 속 수준에 따라 다르게 보였다(Fig. 6). Type 2 휴면포자는 장폭 비가 평균 3.2 (length: 19.6 μm, width: 6.2 μm)로 긴 형태의 원통형을 보이는 Aphanizomenon 휴면포자와 유사하였다(Fig. 6).

Fig. 5
Size variability of cyanobacteria akinetes in different populations.
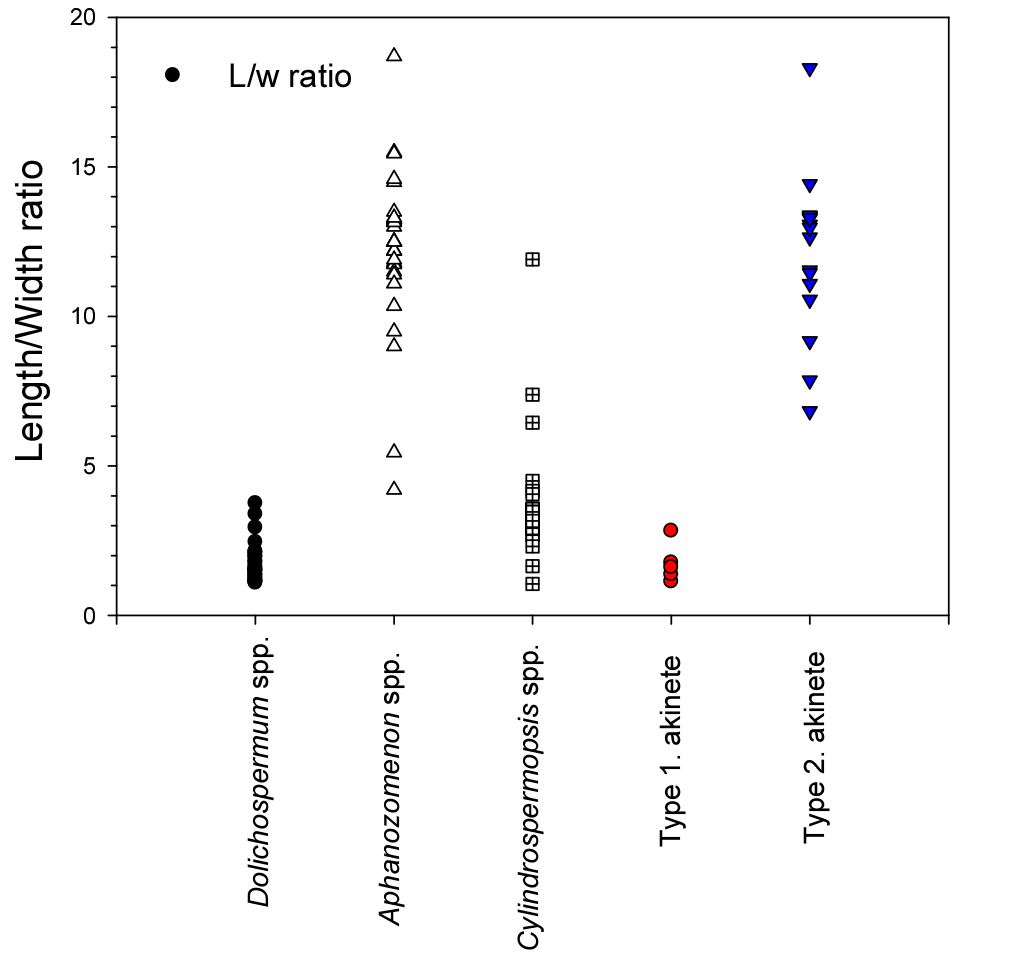
Fig. 6
Length:width ratio variability of cyanobacterial akinetes in different population.
4. 고찰
본 연구에서는 공검지 일대 3개 지점을 대상으로 시추 분석을 실시하였다. 시추된 샘플에 대해서는 10 cm 간격으로 남조류의 휴면포자 분포를 파악하였으며, 이와 동시에 탄소연대분석을 실시하였다. 공검지 일대 3개 지점의 퇴적층에서 출현한 휴면포자는 2가지로 형태로 나타났다. Type 1의 휴면포자는 전형적인 Dolichospermum 속의 휴면포자 형태로 나타났으며(Kwon et al. 2023), type 2의 휴면포자는 형태학적으로 Aphanizomenon속의 휴면포자와 비슷한 형태를 보였다(Fritsch 1945; Rajaniemi et al. 2005). 일반적으로, 염주말목의 휴면포자는 청록색, 포자 모양(spore-like) 및 영양 세포보다 크고 두꺼운 벽을 가진 다층 구조의 외피로 둘러싸여 있다(Nichols and Adams 1982; Herdman 1987, 1988; Adams and Duggan 1999). 본 연구에서 광학 및 전자현미경으로 관찰한 type 1의 휴면포자는 다음과 같은 4가지의 주요 형태학적 특징을 관찰할 수 있었다. 두껍고 둥근 세포벽, 다층 구조의 외피, 세포벽 표면의 사마귀(wart) 구조, 포자 양쪽 끝의 돌기가 그것이다. 일반적으로 Dolichospermum의 휴면포자는 영양세포보다 훨씬 두꺼운 세포벽을 가지고 있으며, 휴면포자 세포벽에 존재하는 돌기와 양쪽 끝의 돌기는 퇴적층의 휴면단계의 세포들과 구별될 수 있는 결정적인 형태적 특징이다. Type 2의 휴면포자의 주요한 특징은 폭은 좁으나 길이가 4배 이상 긴 형태, 포자의 양 끝에 보이지 않는 돌기로 확인되었다. 일반적으로 Aphanizomenon의 휴면포자는 Komárek (2013)에 의해 40 ~ 220×6 ~ 10.8 μm로 보고되었으며 본 연구에서 발견된 type 2 휴면포자는 36 ~ 67×2.2 ~ 9.9 μm, 긴 원통형의 형태를 가지고 있어 폭과 길이의 비율 폭이 4배 이상 나는 것이 결정적인 형태적 특징이다. 따라서 이들의 형태적인 특성을 통해 과거 남조류의 휴면포자와 현재 남조류의 휴면포자 간 형태적 유사성이 존재함을 유추할 수 있었다.
현재까지 남조류를 동정하는 것에 있어서 휴면포자의 모양과 크기는 중요한 분류 특징(key)으로 이용되고 있으며(Stanier et al. 1971; Waterbury and Stanier 1978; Rippka et al. 1979; Rippka and Cohen-Bazire 1983; Castenholz and Waterbury 1989; Watanabe 1998), 특히, 휴면포자 세포 크기에 따른 특정한 장폭 비(length:width ratio)는 남조류 속(genus)에 따라 다르게 나타나 주요 분류 특징으로 알려져 있다(Pang et al. 2018). 하지만 휴면포자 세포 표면의 돌기와 다층 구조 외피는 광학현미경으로는 관찰이 매우 힘들며, 휴면포자 양쪽 끝의 돌기는 현미경 상에서 세포의 위치에 따라 관찰되지 않을 수 있어 형태학적 특징만을 이용하여 자연상태의 휴면포자를 정확히 분류하는 것은 매우 어렵다(Park et al. 2018). 또한 실제로 많은 남조류의 형태학 및 형태계측학적(morphological and morphometrical) 특징은 환경조건에 따라서 매우 다양하게 변할 수 있기 때문에 정확한 동정이 어렵고(Anagnostidis and Komárek 1985, 1988), 더욱이 환경조건에 따른 다양한 형태적 변이종은 현미경 관찰에서 다른 분류군으로 동정 될 수 있다(Castenholz and Norris 2005). 휴면포자의 형태적인 것만으로는 종 동정에 있어 매우 불확실하며 유전자분석 결과를 통하여 확실한 종의 정보를 파악하는 것이 필요함에 따라 퇴적층에서 휴면포자 분리를 통해 발아 후 배양을 통하는 과정이 필수적이며 본 연구팀은 휴면포자를 개별 분리하는데 성공하였으며 현재 발아 배양을 앞두고 있어 유전자 분석을 통한 보다 정확한 종 분석을 통해 과거 공검지에 존재하였던 남조류 신종(미기록종) 발굴에 기대하고 있다. 또한, 본 연구에서는 1,500년대에서부터 기원전 1,800년대까지 다양한 연대의 퇴적환경에서 남조류 휴면포자가 발견되었음과 동시에 온전한 형태를 유지한 채로 관찰이 되었다. 퇴적층의 불리한 환경조건에서도 휴면포자는 생존할 수 있으며(Bolch and Blackburn 1996), 휴면포자의 발아되는 환경조건이 좋아지게 되면 발아하여 수층으로 재유입되는 생활사를 가지고 있기 때문에 휴면포자의 공간적 분포는 남조류 발생에 있어서 장소와 시기를 예측할 수 있는 중요한 단서를 제공할 수 있다(Suikkanen et al. 2010; Kwon et al. 2023). 특히 남조류는 중요한 1차 생산자로서 이들의 군집 조성과 생산성의 변화는 수온, 염도, 영양염류의 변화와 같은 고생태학적인 정보를 제공한다. 따라서 새로운 적정 위치 선정과 심부 시추, 그리고 필요 시 국외 호수퇴적층에 대한 시추를 통해 보완적인 퇴적층 시료를 확보하여 퇴적학적 분석, 미고생물, 동위원소 지화학, 연대측정 분석 등을 분야별로 실시하고 국내외 분석기관을 통해 분석을 수행하게 되면 과거 한반도 기후에도 직접적으로 영향을 미쳐왔던 동아시아 몬순기후에 대한 고기후 변화패턴을 추적할 수 있고 이를 통해 향후 중장기적인 기후 변화 양상도 예측할 수 있는 양질의 자료를 획득할 수 있을 것으로 기대된다(Bergonzini et al. 1997; Williams et al. 2001; Kuwae et al. 2002; Alin and Cohen 2003; Toyoda and Shinozuka 2004; Yamada 2004; Branchu et al. 2005; Filippi and Talbot 2005). 현재 국내 연구진에 의한 국내 호수 및 습지 연구는 매우 간헐적으로 진행되고 있는 상황이며, 그 중 고생물학 연구는 매우 제한되어 있다. 남조류 휴면포자는 화석지표로 활용 할 수 있으며 이러한 연구가 추가된다면 조사 지역의 과거 환경변화에 대한 귀중한 기록을 획득할 수 있으며 그 고생물 데이터를 통해 호수의 환경변화에 대한 해석에 유용하게 이용될 수 있을 것이다.
사사
본 연구는 국립낙동강생물자원관의 ‘미세조류에 의한 담수 퇴적환경의 탄소 흡수 및 저장 기능 규명(1차년도)’(NNIBR202302104)에 의해 수행되었음.
References
Adams DG and Duggan PS. 1999. Heterocyst and akinete differentiation in cyanobacteria. New. Phytol. 144, 3-33.
10.1046/j.1469-8137.1999.00505.x.Alin SR and Cohen AS. 2003. Lake-level history of Lake Tanganyika, East Africa, for the past 2500 years based on ostracode-interred water-depth reconstruction. Palaeogeogr. Palaeoclimatol. Palaeoecol. 199, 31-49.
10.1016/S0031-0182(03)00484-X.Anagnostidis K and Komárek J. 1985. Modern approach to the classification system of Cyanophytes. 1. Introduction. Arch. Hydrobiol. 39, 291-302.
Anagnostidis K and Komarek J. 1988. Modern approach to the classification system of Cyanophytes 3 - Oscillatoriales. Algol. Stud. 50-53 327-472.
Anderson DM and Walls D. 1978. Potential importance of benthic cysts of Gonyaulax tamarensis and G. excavata in initiating toxic dinoflagellate blooms. J. Phycol. 14, 224-234.
10.1111/j.1529-8817.1978.tb02452.x.Anderson DM and Keafer BA. 1985. Dinoflagellate cyst dynamics in coastal and estuarine waters. In: Toxic dinoflagellates. Proc 3rd IntConf. Toxic Dinoflagellates, ed. Elsevier Science, New York, 219-224.
Anderson DM, Gilbert PM and Burkholder JM. 2002. Harmful algal blooms and eutrophication, nutrient sources, composition, and consequences. Estuaries 25, 704-726.
10.1007/BF02804901.Barbiero RP and Welch EB. 1992. Contribution of benthic blue-green algal recruitment to lake populations and phosphorus translocation. Freshw. Biol. 27, 249-260.
10.1111/j.1365-2427.1992.tb00537.x.Bergonzini L, Chalie F and Gasse F. 1997. Paleoevaporation and paleoprecipitation in the Tanganyika Basin at 18,000 years B.P. inferred from hydrologic and vegetation proxies. Quat. Res. 47, 295-305.
10.1006/qres.1996.1879Bolch CJS and Blackburn SI. 1996. Isolation and purification of Australian strains of the toxic cyanobacterium Microcystis aeruginosa Kütz. J. Appl. Phycol. 8, 5-13.
10.1007/BF02186215.Branchu P, Bergonzini L, Delvaux D, Batist MD, Golubev V, Benedetti M and Klerkx J. 2005. Tectonic, climatic and hydrothermal control on sedimentation and water chemistry of northern Lake Malawi(Nyasa), Tanzania. J. Afr. Earth. Sci. 43, 433-446.
10.1016/j.jafrearsci.2005.09.004.Capo E, Debroas D, Arnaud F and Domaizon I. 2015. Is planktonic diversity well recorded in sedimentary DNA? Toward the reconstruction of past protistan diversity. Microb. Ecol. 70, 865-875.
10.1007/s00248-015-0627-2.Castenholz RW and Waterbury JB. 1989. Cyanobacteria. In Staley, J. T., M. P. Bryant, N. Pfennig and J. G. Holt (eds), Bergey's Manual of Systematic Bacteriology Williams and Wilkins, Baltimore 3, 1710-1727.
Castenholz RW and Norris TB. 2005. Revisionary concepts of species in the cyanobacteria and their applications. Algol. Stud. 117, 53-69.
10.1127/1864-1318/2005/0117-0053.Cheong DK and Kim B-H. 2008. Domestic and oversea research activities and future studies of paleoclimatology from lake and wetland sediments. J. Geo. Soc. Korea 44(1), 81-92.
Collman AW. 1983. The roles of resting spores and akinetes in chlorophyte survival. In: Survival Strategies of the Algae, Fryxell GA, ed. Cambridge University Press, London, U.K., 1-21.
Daegu Regional Environmental Office (DREO). 2014. Gonggeom wetland ecosystem monitoring, Korea. http://www.me.go.kr/daegu.
Dale B. 1977. Cysts of the toxic red-tide dinoflagellate Gonyaulax excavata (Braarud) Balech from Oslofjorden, Norway. Sarsia 63, 29-34.
10.1080/00364827.1977.10411318.Domaizon I, Savichtcheva O, Debroas D, Arnaud F, Villar C, Pignol C, Alric B and Perga M. 2013. DNA from lake sediments reveals the long-term dynamics and diversity of Synechococcus assemblages. Biogeosci. 10(2), 2515-2564.
10.5194/bg-10-3817-2013.Filippi ML and Talbot MR. 2005. The palaeolimnology of northern Lake Malawi over the last 25ka based upon the elemental and isotopic composition of sedimentary organic matter. Quat. Sci. Rev. 24, 1303-1328.
10.1016/j.quascirev.2004.10.009.Fritsch FE. 1945. The structure and reproduction of the algae, Vol. 2. ed. Cambridge University Press, London, U.K.
Herdman M. 1987. Akinete: structure and function. In: The cyanobacteria. Fay P, van Baalen C, ed. Elsevier, Amsterdam, 227-250.
Herdman M. 1988. Cellular differentiation: Akinetes. In Methods in enzymology (Vol. 167, pp. 222-232). Academic press.
10.1016/0076-6879(88)67024-8Hwang S, Kim JY and Kim S. 2014. Environmental changes and embankment addition of Reservoir Gonggeomji, Sangju City between late Silla-and early Goryeo Dynasty. J. Korean Geomorphol. Assoc. 21, 165-180. http://dx.doi.org/10.16968/JKGA.21.4.12.
10.16968/JKGA.21.4.12Kaplan-levy R, Hadas O, Summers ML, Rücker J and Sukenik A. 2010. Akinetes: Dormant Cells of Cyanobacteria. Dormancy and Resistance in Harsh Environments. ed. Springer-Verlag, Berlin and Heidelberg, pp. 5-27.
10.1007/978-3-642-12422-8_2Kim MH, Hwang JH, Choi EY, Park J and Park JK. 2017. Insect Diversity on the Paddy Field Wetland, Gonggeom-ji, Sangju, first designed by Ministry of Environment, Korea. J. Wetl. Res. 19(1), 155-163.
10.17663/JWR.2017.19.1.155.Kim YO and Han MS. 2000. Seasonal relationships between cyst germination and vegetative population of Scrippsiella trochoidea (Dinophyceae). Mar. Ecol. Prog. Ser. 204, 111-118. https://www.jstor.org/stable/24863627.
10.3354/meps204111Komárek J. (2013). Süßwasserflora von Mitteleuropa, Bd. 19/3: Cyanoprokaryota 3. Teil/3rd part: Heterocytous Genera. Süßwasserflora von Mitteleuropa. Spektrum Academischer Verlag, Heidelberg.
10.1007/978-3-8274-2737-3Kuwae M, Yoshikawa S and Inouchi Y. 2002. A diatom record for the past 400ka from Lake Biwa in Japan correlates with global paleoclimatic trends. Palaeogeogr. Palaeoclimatol. Palaeoecol. 183, 261-274.
10.1016/S0031-0182(01)00490-4.Kwon D, Kim K, Jo H, Lee SD, Yun SM and Park C. 2023. Environmental factors affecting akinete germination and resting cell awakening of two cyanobacteria. Appl. Microsc. 53(1), 1-13.
10.1186/s42649-023-00085-6.Lee SD, Lee H, Park J, Yun SM, Lee JY, Lim J, Park M and Kwon D. 2020. Late Holocene diatoms in sediment cores from the Gonggeomji Wetland in Korea. Diatom Res. 35(3), 195-229.
10.1080/0269249X.2020.1749136.Legrand B, Lamarque A, Sabart M and Latour D. 2017. Benthic archives reveal recurrence and dominance of toxigenic cyanobacteria in a eutrophic lake over the last 220 years. Toxins. 9(9), 271.
10.3390/toxins9090271.Lim CG, Kim YH and Roh YH. 2011. The rice paddy wetland ecotourism resources and suggestions: a case study of Sangju Gonggeumji. Journal of the Korean Association of Regional Geographers 17(3), 313-331.
Martinez De La Escalera G, Antoniades D, Bonilla S and Piccini C. 2014. Application of ancient DNA to the reconstruction of past microbial assemblages and for the detection of toxic cyanobacteria in subtropical freshwater ecosystems. Mol. Ecol. 23(23), 5791-5802.
10.1111/mec.12979.Nam SI and Kim SY. 2011. A brief review of palynological studies The western Arctic paleoenvironmental changes. J. Geo. Soc. Korea 47(5), 547-560.
Nehring S. 1996. Recruitment of planktonic dinoflagellates: importance of benthic resting stages and resuspension events. Int. Rev. Gesamten Hydrobiology 81(4), 513-527.
10.1002/iroh.19960810404.Nichols JM and Adams DG. 1982. akinete. In: The Biology of Cyanobacteria. Carr NG and Whitton BA, ed. Blackwell Scientific Publishers, Oxford, 387-412.
Pang K, Tang Q, Chen L, Wan B, Niu C, Yuan X and Xiao S. 2018. Nitrogen-fixing heterocystous cyanobacteria in the Tonian period. Curr. Biol. 28(4), 616-622.
10.1016/j.cub.2018.01.008.Park CH, Park MH, Kim KH, Park JH, Kwon DR, Kim NY, Lim BJ and Hwang SJ. 2018. Akinete germination chamber: an experimental device for cyanobacterial akinete germination and plankton emergence. Harmful Algae 72, 74-81.
10.1016/j.hal.2018.01.004.Pospelova V and Kim SJ. 2010. Dinoflagellate cysts in recent estuarine sediments from aquaculture sites of southern South Korea. Mar. Micropaleontol. 76, 37-51.
10.1016/j.marmicro.2010.04.003.Rajaniemi P, Hrouzek P, Kaštovska K, Willame R, Rantala A, Hoffmann L, Komárek J and Sivonen K. 2005. Phylogenetic and morphological evaluation of the genera
Anabaena, Aphanizomenon, Trichormus and
Nostoc (Nostocales, Cyanobacteria). Int. J. Syst. Evol. Microbiol. 55(1), 11-26.
10.1099/ijs.0.63276-0.Rippka R and Cohen-Bazire G. 1983. The Cyanobacteriales: a legitimate order based on type strain
Cyanobacterium stanieri? Ann. Microbiol. 134B, 21-36.
10.1016/S0769-2609(83)80094-5.Rippka R, Deruelles J, Waterbury JB, Herdman M and Stanier RY. 1979. Generic assignments, strain histories and properties of pure cultures of cyanobacteria. J. Gen. Microbiol. 111, 1-61.
10.1099/00221287-111-1-1.Savichtcheva O, Debroas D, Perga ME, Arnaud F, Villar C, Lyautey E, Kirkham A, Chardon C, Alric B and Domaizon I. 2015. Effects of nutrients and warming on
Planktothrix dynamics and diversity: a palaeolimnological view based on sedimentary DNA and RNA. Freshw. Biol. 60(1), 31-49.
10.1111/fwb.12465.Shin JK, Jeon GH, Kim YS, Kim MK, Kim NY and Hwang SJ. 2017. Recruitment Potential of Cyanobacterial Harmful Algae (Genus
Aphanizomenon) in the Winter Season in Boryeong Reservoir, Korea: Link to Water-level Drawdown. J. Ecol. Environ. 50, 337-354.
10.11614/KSL.2017.50.3.337.Stanier RY, Kunisawa R, Mandel M and Cohen-Bazire G. 1971. Purification and properties of unicellular blue-green algae (Order Chroococcales). Bacteriol. Rev. 35, 171-205.
10.1128/br.35.2.171-205.1971.Suikkanen S, Kaartokallio H, Hällfors S, Huttunen M and Laamanen M. 2010. Life cycle strategies of bloom-forming, filamentous cyanobacteria in the Baltic Sea. Deep Sea. Res. 2 Top. Stud. Oceanogr. 57(3-4), 199-209.
10.1016/j.dsr2.2009.09.014.Takamura N, Yasuno M and Sugahara K. 1984. Overwintering of
Microcystis aeruginosa Kütz. in a shallow lake. J. Plankton. Res. 6, 1019-1029.
10.1093/plankt/6.6.1019.Toyoda K and Shinozuka Y. 2004. Validation of arsenic as a proxy for lake-level change during the past 40,000 years in Lake Biwa, Japan. Quat. Int. 123-125, 51-61.
10.1016/j.quaint.2004.02.008.Watanabe M. 1998. Studies on planktonic blue-green algae 8.
Anabaena species with twist trichomes in Japan. Bull. Natn. Sci. Mus. 24, 1-13.
Waterbury JB and Stanier RY. 1978. Patterns of growth and development in Pleurocapsalean cyanobacteria. Microbiol. Rev. 42, 2-44.
10.1128/mr.42.1.2-44.1978.Williams DF, Kuzmin MI, Prokopenko AA, Karabanov EB, Khursevich GK and Bezrukova EV. 2001. The Lake Baikal drilling project in the context of a global lake drilling initiative. Quat. Int. 80-81, 3-18.
10.1016/S1040-6182(01)00015-5.Wood SA, Jentzsch K, Rueckert A, Hamilton DP and Cary SC. 2009. Hindcasting cyanobacterial communities in Lake Okaro with germination experiments and genetic analyses. FEMS Microbiol. Ecol. 67(1980), 252-260.
10.1111/j.1574-6941.2008.00630.x.Yamada K. 2004. Last 40ka climate changes as deduced from the lacustrine sediments of Lake Biwa, central Japan. Quat. Int. 123-125, 43-50.
10.1016/j.quaint.2004.02.007.