1. 서론
2. 재료 및 방법
2.1 토착 미세조류 균주 순수분리
2.2 형태학적 및 분자 생물학적 동정
2.3 배양 조건 및 성장 특성 측정
2.4 원소분석
2.5 바이오매스의 생화학적 분석
2.6 지방산 및 바이오 디젤 품질 분석
3. 결과 및 고찰
3.1 토착 미세조류 균주의 분리 및 동정
3.2 성장특성
3.3 바이오매스 원소분석
3.4 바이오매스 생화학적 분석
3.5 지방산 및 바이오 디젤 품질 분석
4. 결론
1. 서론
선진국을 중심으로 2050년까지 탄소중립을 선언하며 급변하는 기후변화에 대응하기 위한 전 지구적인 문제 해결을 위한 노력이 이어지고 있다(International Energy Agency, 2022a). 이를 달성하기 위하여 전세계적으로 신재생에너지원에 대한 수요가 증가하고 있으며 대체에너지원 산업의 효과적인 개발을 위해 다양한 논의가 진행되고 있다.
미세조류는 광합성을 통해 대기 중 이산화탄소를 흡수할 수 있어 친환경 탄소흡수원으로 각광받고 있으며, 그 과정에서 건강보조제, 화장품, 의약품 분야에서 높은 활용성을 지니는 다양한 색소와 같은 고부가가치 산물을 생산할 수 있다(Chini Zittelli et al. 2023; Das et al. 2011). 또한 미세조류 바이오매스로부터 추출되는 지질은 식용 오일, 차세대 바이오 연료로써 주목받고 있는데, 곡물류와 같은 이전 세대 바이오 연료의 경우, 복잡한 국제 정세와 곡물가격의 연계로 시장의 영향을 받아 가격 변동이 심해지는 특징을 지니고 있기 때문이다(International Energy Agency 2022b; Xue et al. 2018). 미세조류는 또한 기존세대의 바이오 연료에 비해 단위면적당 생산성이 높고, 식량자원과 경쟁하지 않으며 토착 환경에 크게 영향을 받지 않고 배양이 가능하다는 점을 바탕으로 안정적인 공급을 이룰 수 있어 바이오 디젤 추출을 위한 유망한 접근법으로 여겨진다(Ahmad et al. 2022; Chisti 2007; Mata et al. 2010).
그러나 전세계 약 7만여종에 달하는 수많은 미세조류 중에서 우리가 유용하게 활용할 수 있는 균주를 선별하기 위해서는 특성을 확인하는 작업이 필수적이다. 특히 미세조류의 생리적 특성은 성장환경 및 스트레스 유무에 따라 구성 비율의 변화가 수반될 수 있기 때문에 면밀한 관찰이 요구된다(Knothe 2011). 미세조류의 배양에는 기본적으로 많은 물과 영양분의 공급이 필요하며 대략적으로 전체 배양 비용의 50% 가량을 차지하는 것으로 알려져 있다(Singh and Das 2014). 이로 인해 야기되는 낮은 경제성을 극복하기 위한 방안 중 하나로 배양 후 수확한 바이오매스로부터 바이오연료을 추출하고 잔여 바이오매스로부터 적합한 지방산, 혹은 2차 대사산물과 같은 고부가가치 물질을 생산하여 비용을 절감하고 환경 측면에서도 이익을 도모할 수 있다(Alazaiza et al. 2022).
울릉도와 독도는 한반도 동쪽에 위치한 화산활동으로 생겨난 대양도서로 다양한 자생종이 존재하는 환경으로 알려져 있다. 섬의 지하수에서 발원한 수계와 주변의 풍부한 환경으로부터 다양한 미생물과 균류들을 발견할 수 있다. 울릉도 유래 미세조류에 대한 연구는 박테리아와 곰팡이에 비하여 상대적으로 제한적이기 때문에 보다 체계적인 접근이 필요하다. 최근 UN이 주도하는 지속가능한 발전 목표(SDG)에 따라 해양자원의 보전과 효과적인 관리가 지속가능한 발전을 위해 필요한 것으로 인식되고 있다. 울릉도 및 독도를 포함한 동해안의 지리적 중요도를 고려하였을 때 인근 해역에서 생물자원을 확보하는 것은 생물주권의 확보 및 주장에 있어서도 그 필요성이 증가할 것으로 예상된다.
본 연구에서는 대한민국 경상북도 울릉군 울릉도에서 단세포 미세조류 Coelastrella rubescens KNUA201을 순수분리하고 분자적 동정을 진행하였다. 그 후 미세조류의 성장을 추적하며 생리적 특징을 조사하였으며 수확 후 획득한 바이오매스를 이용하여 생화학적 특성분석을 진행하였다. 마지막으로 원소분석 및 지방산분석을 통해 미세조류 바이오매스의 바이오 에너지 원료로써 활용가능성을 탐색하였다. 이를 바탕으로 울릉도 유래 토착 미세조류 생물자원의 확립, 성장 특성의 파악과 바이오매스의 활용 방안 가능성을 조사하였으며 이러한 결과는 향후 해당 종의 산업적 활용의 토대가 될 수 있을 것으로 사료된다.
2. 재료 및 방법
2.1 토착 미세조류 균주 순수분리
울릉도의 담수 웅덩이로부터 샘플을 채집하였다. 실험실로 옮긴 후 100 mL 플라스크에 1 mL의 샘플을 옮겨 담은 후 해당 미세조류의 성장이 육안으로 관찰될 때까지 오비탈 쉐이커(Vision Scientific, Korea)에서 160 rpm, 25℃의 조건으로 배양하였다. 성장한 배양액 1.5 mL을 15분간 3000×g로 원심분리 하여 세포를 침전시켰다. 침전시킨 pellet은 기타 오염원을 제거하기 위해 순수분리가 이루어질 때까지 Imipenem 항생제 100 μL mL–1가 첨가된 BG-11 고체 배지에 획선도말하여 25℃, 명암주기 16 : 8 h 조건으로 유지하였다.
2.2 형태학적 및 분자 생물학적 동정
18S ribosomal RNA (rRNA), Internal transcribed spacer (ITS), tufA 유전자 서열을 이용하여 분자적 종 동정을 진행하였다. 18S rRNA 서열의 증폭을 위해 NS1 (5’-GTA GTC ATA TGC TTG TCT C - 3’), NS8 (5’-TCC GCA GGT TCA CCT ACG GA - 3’) primer를 이용하였으며, ITS2 서열의 경우 ITS1 (5’-TCC GTA GGT GAA CCT GCG G - 3’), ITS4 (5’- TCC TCC GCT TAT TGA TAT GC - 3’) primer를 사용하였고, tufA 서열은 tufa-F (5’-GGN GCN GCN CAA ATG GAY GG - 3’), tufa-R (5’- CCT TCN CGA ATM GCR AAW CGC - 3’) primer를 이용하였다(Vieira et al. 2016; White et al. 1990).
PCR Premix (Bioneer, Korea)에 genomic DNA 1.0 μL, 각 primer 1.0 μL, 멸균된 dH2O 17 μL을 첨가하여 총 20 μL양으로 Takara thermocycler (Takara, Japan)를 이용하여 증폭하였다. 증폭조건은 사용한 primer에 따라 다르게 진행하였다. 18S rRNA의 경우, 2분간 94℃에 두어 Pre denaturation 이후, 30초간 94℃에 두어 변성, 45초간 45℃에 두어 primer의 결합, 90초간 72℃ 두어 elongation 과정을 30회 반복하였다. 최종적으로 5분간 72℃에 두어 extension하였다. ITS의 경우, 3분간 94℃에 둔 이후, 30초간 92℃, 30초간 50℃, 60초간 72℃에 두는 과정을 30회 반복하였다. 최종적으로 10분간 72℃에 두어 extension하였다. PCR 산물은 pGEM easy vector (Promega, USA)를 이용하여 insertion되었고 Escherichia coli DH5α competent cell에 형질도입 되었으며, Dokdo plasmid mini-prep 키트(Elpis-Biotech, Korea)를 이용하여 플라스미드를 분리한 후 Macrogen 사에 서열분석을 의뢰하였다.
진행된 실험으로부터 알아낸 18S rRNA, ITS, tufA 서열을 National Center for Biotechnology Information (NCBI)의 Blast를 이용하여 유연관계가 가까운 종들에 대한 서열에 대한 정보를 얻었다. 해당 서열들은 MEGA version 10.2.1에서 ClustalW를 이용하여 정렬되었으며 Kimura 2-parameter+Gamma distributed with Invariant sites (K2+G+I)을 이용한 Maximum likelihood 계통 추론법으로 계통수를 얻었고, Bootstrap는 Felsentein에 의해 1,000회 진행되었다.
2.3 배양 조건 및 성장 특성 측정
2.3.1 배양 조건
배양실의 환경은 25℃, 146 µmole m–2 sec–1, 16:8 h 광주기로 설정되었다. 획선도말된 KNUA201 균주의 단일 군집을 100 mL BG-11 배양액이 있는 플라스크에 접종하여 배양하였다. 4일간 배양 후 BG-11 500 mL이 담긴 1 L 삼각 플라스크에 접종하였으며 오비탈 쉐이커에서 1~3% 이산화탄소를 공급하고 160 rpm으로 교반하며 배양하였다.
2.3.2 성장률 및 건중량 측정
7일 간의 배양기간 동안 미세조류 성장특성을 조사하기 위하여 매일 10 mL의 샘플을 채취하였다. 분광 광도계(UV-1900i, Shimadzu, Japan)를 이용하여 680 nm 파장대에서의 흡광도를 측정해 근사적인 성장곡선을 파악하였으며, Neubauer improved C-chip (DHC-N01, NanoEntek, Korea)를 이용하여 세포수를 계수하였다.
건중량 측정은 American Public Health Association (APHA)에 의해 권고되는 표준화된 2540D protocol을 따라 진행하였으며, 7일차의 배양액 5 mL을 진공여과장치(Merck Millipore, XX1514700)을 이용하여 GF/C filter (47 mm, Whatman, Germany)에 여과하였다. 여과된 필터는 105℃로 설정된 오븐(WOF-W155, WiseVen, Germany)에서 24시간 건조 시킨 후 여과 전 후의 필터 중량을 측정하였다.
2.3.3 엽록소 및 총 카로티노이드 함량 측정
샘플 2 mL를 4000×g에서 5분간 원심분리(5810R, Eppendorf, Germany)하여 세포를 침전시킨 후 상등액을 제거하였다. 차가운 Methanol (Merck, USA) 1 mL로 현탁한 샘플은 초음파 세포 파쇄기(Model 550, Fisher Scientific, USA)를 이용하여 40 Hz에서 30분 동안 파쇄하였다. 빛이 없는 환경에서 24시간 동안 방치한 후 원심분리로 잔해들을 가라앉힌 후, 분광 광도계를 이용하여 473 nm, 653 nm, 666 nm에서 흡광도를 측정하였다. 추출된 엽록소 a, b, 및 총 카로티노이드 함량 분석을 위해 Wellburn 의 식을 활용하였다(Wellburn 1994).
Chl a (μg mL–1)=15.65∙A666–7.34∙A653
Chl b (μg mL–1)=27.05∙A653–11.21–A666
Total carotenoid (μg mL–1)=(1000∙A473–2.86∙Chl a–129.2∙Chl b)/221
2.3.4 형태학적 관찰
Zeiss axiolab5 (Carl Zeiss, Germany) 광학 현미경의 1000×확대비율로 관찰하였다. 사진은 현미경에 부착된 Zeiss Axiocam 208 color를 이용하였다.
2.4 원소분석
배양 후 7일차에 미세조류 배양액을 4000×g에서 5분간 원심분리하여 수확하였다. 수확한 바이오매스는 동결건조(PVTFD20R, Ilshin, Korea) 후 분석 전까지 70℃에 보관하였다. 동결 건조한 샘플을 막자사발을 이용하여 곱게 갈아준 뒤, 63 μm 직경의 ASTM NO.203 체를 이용하여 균질화하였다.
원소분석기(Flash 2000, Thermo Fisher Scientific, Italy)를 이용하여 탄소, 수소, 질소, 산소, 황 성분을 분석하였다. Calorific value (CV)의 경우 Given 에 의해 고안된 다음 식을 활용하였다(Given et al. 1986).
CV=0.3278C+1.419H+0.09257S–0.1379O+0.637 (MJ∙kg–1)
2.5 바이오매스의 생화학적 분석
바이오매스의 탄수화물 함량은 phenol-sulfuric acid 비색법을 이용하여 측정하였다(Nielsen 2010). 동결 건조된 미세조류 50 mg을 glass vial에 넣은 후 2 N의 H2SO4 2.5 mL를 첨가한다. 3시간동안 100℃의 항온수조에서 반응한 후, 상온에 두어 실온까지 식힌다. 이후 NaCO3를 첨가하며 중화시킨 후 증류수를 이용해 1 mg mL–1 농도로 샘플을 희석하였으며, 희석한 샘플을 5분간 4000×g로 원심분리 후 0.2 μm PVDF syringe filter (PV1322, Chromdisc, Korea)로 여과 뒤 측정에 사용하였다. 농도별로 준비된 샘플에 50 μL의 80% (w/v) phenol (Sigma, St. Louis, MO, USA)과 5 mL의 sulfuric acid (Sigma, USA)를 차례대로 첨가하였으며 30분간 상온에서 반응 후 분광 광도계를 이용하여 490 nm에서 흡광도를 측정하였다. 측정된 값은 glucose standard와 비교해 계산하였다.
단백질은 원소분석을 통해 획득한 질소 함량에 전환인자 6.25를 곱하여 단백질 성분의 질량 백분율을 계산하였다(Mariotti et al. 2008).
총 지질함량은 Sulfo-Phospho-Vanillin (SPV)을 이용하여 측정하였다. 0.6% (w/v) vanillin (Sigma, USA) 용액을 준비한 후 phosphoric acid (Duksan, Korea) 400 mL를 첨가하여 총량 500 mL의 Phosphor-vanillin (PV)용액을 제작하였다. 10 mg mL–1 샘플을 농도별로 준비한 후 98% 황산 2 mL를 첨가하였다. 100℃에서 10분간 항온수조에서 반응 후, 5분간 얼음에서 식혔다. 이후 PV용액 5 mL를 첨가하고 200 rpm으로 15분간 37℃에서 반응하였으며 흡광도 측정은 530 nm에서 이루어졌다.
2.6 지방산 및 바이오 디젤 품질 분석
2.6.1 바이오매스의 지방산 분석
변형된 Bligh and Dyer의 지질 추출방식을 활용하였다. Chloroform (Sigma, USA)과 methanol (Merck, USA)의 혼합비율을 4:5 (v/v)으로 이용하였고, bead beating 과정이 추가되었다(Breuer et al. 2013). 추출된 지질에서 지방산을 분리하기 위해 transesterification 과정을 거쳤다. MeOH가 첨가된 5% H2SO4 (v/v)를 CH3Cl을 증발시킨 지질에 3 mL 첨가 후 섞어준다. 70℃ 항온 욕조에서 30분간 섞어주며 3시간 방치한다. 상온에 두어 식힌 뒤 dH2O와 hexane (Sigma, USA)를 각각 3 mL 첨가하고 15분간 오비탈 쉐이커로 섞어준다. 5분간 1200×g로 원심분리 후 유기용매 층에서 2 mL를 새로운 glass tube에 옮기고, 2 mL의 dH2O를 넣고 섞어주어 유기용매를 씻어준다. 동일한 조건으로 원심분리를 다시 진행하고 0.2 μm PVDF syringe filter로 여과하여 -20℃에서 보관하였다.
추출한 지방산은 mass selective detector (5975C, Agilent, USA)와 DB-FFAP column (30 m×0.25 mm×0.25 μm; Agilent, USA)이 장착된 GC/MS (7890N, Agilent, USA)를 이용하여 분리되었다. 헬륨을 이동상으로 이용하였으며, 이동 속도는 1 mL min–1, 관 압력은 52 kPa였다. 초기 오븐 온도는 50℃로 1분간 둔 후 10℃ min−1의 비율로 200℃까지 상승시키고 30분간 유지하였다. 시료주입장치의 분할 비율은 20:1이었다.
2.6.2 지방산 결과를 바탕으로 한 바이오 디젤 품질 분석
GC/MS로 확인된 지방산 결과를 바탕으로 바이오 디젤 품질을 결정하는 값들을 파악하였다. Saponification value (SV), Iodine value (IV), Cetane number (CN), Long chain saturation factor (LCSF), Cold filter plugin point (CFPP), High heating value (HHV), Degree of unsaturation (DU), Kinematic viscosity of at 40℃ (υ), Density at 20℃ (ρ), and Oxidative stability (OS) 값을 도출하였다. 결과값은 EN14214 및 ASTM D6751 protocol과 비교하여 평가하였다.
MUFA는 하나의 이중결합이 포함된 지방산, PUFA는 두개 이상의 이중결합이 포함된 지방산을 의미하며, D는 이중결합 개수, 는 해당 성분의 비율을 는 해당 성분의 분자량을 뜻한다(Gopinath et al. 2009; Krisnangkura 1986; Ramírez-Verduzco et al. 2012). X는 리놀렌산, 리놀레산의 질량 백분율을 의미한다(Park et al. 2008).
3. 결과 및 고찰
3.1 토착 미세조류 균주의 분리 및 동정
현미경을 통한 형태학적 관찰 결과 다양한 세포수가 관찰되었으며, 단일세포로 존재하는 경우도 있었으나, 4개까지 모여 있는 영양세포들도 관찰되었다(Fig. 1(a), (b)). 대략적으로 8±2 μm 직경으로 원형에서 타원형, 레몬모양까지 다양한 형태를 보였다. 편모는 관찰되지 않았으며, 자포자는 4개로 구성되어 있고 자포자막이 파열되는 것도 관찰할 수 있었다. 파열된 자포자막에서 나온 세포의 경우 타원형의 양끝이 뾰족한 형태의 단일 세포가 관찰되었다. 세포막 피하에 벽돌과 같이 응집되어 조각난 형태로 엽록체(parietal chloroplast)가 존재했다. 이러한 형태학적 특징은 분리한 KNUA020 균주가 Coelastrella rubescens의 구성원임을 나타낸다 (Minyuk et al. 2016; Wang et al. 2019). 분자생물학적 분석에 따르면 18S rRNA, ITS, tufA 서열분석에서 유추된 결과는 상호 일관성이 있으며 유전자 서열 분석 결과 모두 C. rubescens와 높은 일치도를 보이는 것으로 나타났다(Fig. 1(c)−(e), Table 1). 따라서 형태학적 특징 및 높은 유전자 서열 분석 결과를 바탕으로 KNUA201의 이름은 C. rubescens일 가능성이 높은 것으로 확인된다.

Fig. 1.
The light microscope image of C. rubescens KNUA201 at ×1,000 magnification. (a) Unicellular citriform vegetative state. (b) Autospore state with 4 cells. The phylogenetic relationship of Coelastrella sp. KNUA201 and its closely related species inferred from (c) 18S rRNA, (d) ITS, and (e) tufA sequence data. The numbers at nodes indicate the percentage values given by 1,000 bootstrap analysis samples. The scale bar represents 1% difference in nucleotide sequences.
Table 1.
Results from BLAST searches using the ITS, 18S rRNA, and tufA sequences of C. rubescens KNUA201.
3.2 성장특성
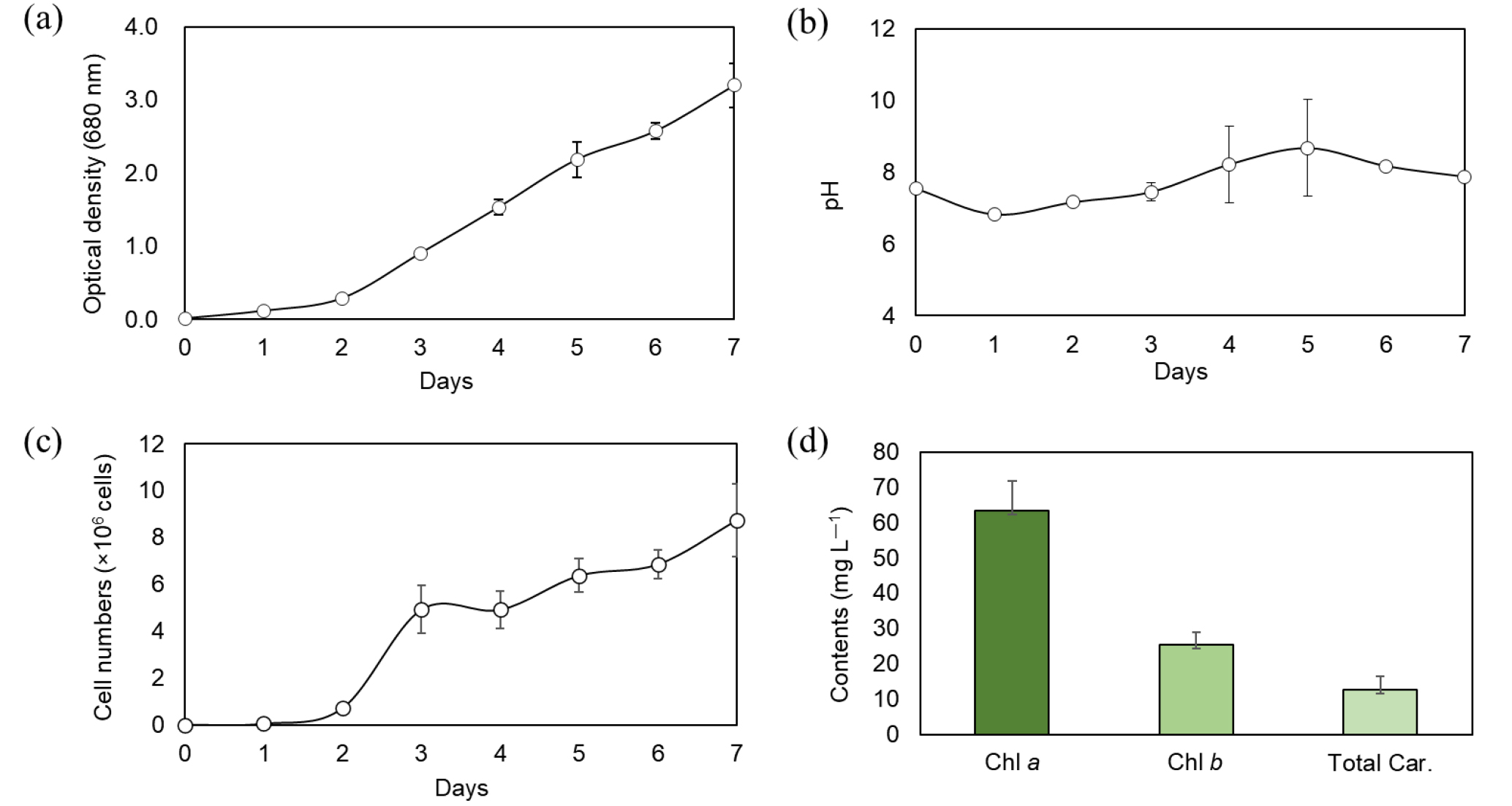
세포의 성장곡선에서 지수적 성장기를 거쳐 접종 후 3일차에 대수기에 접어들었으며 정체기에 접어들 때 배양액을 수확하였다. 성장시기 동안 7~8의 일정한 pH가 유지되게 1~3%로 CO2의 양을 조절하였다. C. rubescens KNUA201 균주는 배양 7일차에 680 nm에서의 3.2의 흡광도를 나타냈으며, 7일차 수확일의 바이오매스의 건중량은 1.34 g L–1으로 측정되었다(Fig. 2(a)–(c)). 흡광도(OD680)을 바탕으로 작성한 specific growth rate (μ)의 경우 2.43 d–1로 확인되으며 이는 이미 알려진 Chlorella minutissima의 0.66 d–1, Botryococcus sp. strain SK의 0.135 d–1, Neochloris eleoabundans의 1.92 d–1, Ettlia sp. YC001의 0.17 d–1 균주들의 값을 상회하는 것으로 C. rubescens KNUA201의 성장속도를 바탕으로 다양한 바이오매스의 활용 가능성을 기대해 볼 수 있는 수치이다(Singh and Singh 2015; Yoo et al. 2013, 2015).
엽록소는 7일차에 수확한 샘플로 Methanol을 이용하여 추출 후 Wellburn 계산식을 이용하였다. 엽록소 a는 63.29 mg L–1, 엽록소 b는 25.42 mg L–1, total carotenoid는 12.55 mg L–1의 함량을 보였다(Fig. 2(d)). Coellastrella 균주를 이용한 다른 연구결과와 비교해 보았을 때, 보조색소의 생성, 주색소의 감소는 스트레스 환경을 확인할 수 있는 척도가 될 수 있는데, 보조색소/주색소 질량비 값이 높을수록 특정 성장환경이 스트레스로서 작용하는 것을 알 수 있다(Minyuk et al. 2016). 이를 토대로 본 연구의 성장 환경이 스트레스로 작용하지 않음을 알 수 있다. 다만 C. rubescens KNUA201의 성장환경은 Minyuk et al. 연구의 조건과 유사하나 세포수를 토대로 한 초기성장속도에 차이가 있었는데 이는 BG-11과 BBM이라는 서로 다른 배지에서 기인한 것으로 보인다. Coelastrella 균주의 최적 배지를 결정하기 위해서는 동일한 성장환경에서의 추가 실험이 필요하다.
3.3 바이오매스 원소분석
원소분석 결과를 바탕으로 CV 값을 산출하였으며 C. rubescens KNUA201 바이오매스는 25.1 MJ kg–1를 가지는 것으로 나타났다(Table 2). 생물 자원으로서 농, 임업 산업 잔재의 바이오매스 14.3~25.4 MJ kg–1, 옥수수, 밀, 해바라기와 같은 농작물 기반 바이오매스의 경우 13.5~17.6 MJ kg–1의 CV 값을 가지는 것으로 알려져 있으며 이와 비교하였을 때 C. rubescens KNUA201 균주는 바이오 에너지원으로서 활용될 수 있는 가능성을 지닌 것으로 보인다(Gravalos et al. 2016; Jóvér et al. 2018).
Table 2.
Elemental analysis of microalgal biomass.
| Elemental composition | Component (%) |
| C | 53.4±0.1 |
| H | 7.3±0.1 |
| O | 25.8±0.1 |
| N | 9.4±0.1 |
| S | 0.5±0.1 |
| CVa | 25.1 MJ kg–1 |
3.4 바이오매스 생화학적 분석
7일간 배양 후 수확한 미세조류 바이오매스의 탄수화물의 건조 질량 백분율은 25.82±3.33%, 단백질은 58.93±0.33%, 지질은 16.73±1.96%으로 나타났다(Table 3). 산업적으로 주로 이용되는 미세조류 균주인 Chlorella vulgaris와 Arthrospira sp.의 경우 건중량의 약 51~58%가 단백질 함량으로 고단백 기능식품 첨가에 사용되는데, 해당 종을 상회하는 높은 단백질 함량이 특징적이다(Boukid et al. 2021; Wang et al. 2021). 미세조류는 성장단계별 뿐만 아니라 빛, pH, 염분 등 다양한 배양 환경 조건에 따라 생화학적 조성이 달라질 수 있다(Juneja et al. 2013; Williams and Laurens 2010). 하지만 일정하게 제한된 연구실 환경에서 각각의 함량을 확인하였으므로 본 결과를 바탕으로 울릉도 내 담수 웅덩이로부터 분리한 녹조류인 C. rubescens KNUA201 균주는 일반적으로 높은 단백질 함량으로 지니고 있으며 단백질 원료 공급에 적합한 이점을 가지고 있다고 사료된다.
Table 3.
Biochemical composition of microalgal biomass.
| Component (%wt) | |
| Total carbohydrate | 25.82±3.33 |
| Total protein | 58.93±0.33 |
| Total lipid | 16.73±1.96 |
3.5 지방산 및 바이오 디젤 품질 분석
GC/MS를 이용한 C. rubescens KNUA201의 지방산 분석을 통해 알파 리놀렌산(C18:3 (ω3))이 전체 지방산 결과의 약 30%를 차지하며 구성성분 중 가장 많은 것으로 나타났다(Table 4). 두번째로 높은 함량을 보였던 지방산은 팔미트산(C16:0)으로 약 14%의 비율을 나타냈으며, 리놀레산(C18:2)이 약 11%로 세번째로 많은 비율을 차지했다. 지방산 함량 중 PUFA (다중 불포화지방산)의 비율이 58.311%, MUFA (단일 불포화지방산)는 7.307%를, SFA (포화지방산)는 14.829%를 차지했다. Coelastrella 속을 이용한 다양한 선행연구에서 BBM, TAP 배양액에서 키운 경우에서도 C16에서 C18 길이의 지방산 성분들이 주를 이루었으며, 불포화도에 있어서는 서로 다른 다양성을 보였다(Maltsev et al. 2021; Minyuk et al. 2016; Saito et al. 2023; Toshkova-Yotova et al. 2022). Coelastrella sp. KNUA201은 높은 PUFA 생산량을 바탕으로 채식주의자를 위한 건강기능식품의 원료로 제공될 수 있을 것이다.
최근 미세조류 바이오매스가 지닌 지질의 양 뿐만 아니라 국제 바이오 디젤 기준을 맞출 수 있는 구성성분 분석의 필요성이 높아지고 있다. 따라서 지방산 GC/MS 결과를 토대로 C. rubescens KNUA201의 바이오 디젤로써 활용 가능성을 판별하기 위해 유럽의 EN14214, 미국의 ASTM D6751 기준과 비교하였다(Table 5). C. rubescens KNUA201 균주는 스트레스 환경이나 그에 준하는 처리를 하지 않았음에도 지방산 결과를 토대로 계산된 바이오 디젤 품질 결과 국제 규격(EN14214, ASTM D6751)에 대입하였을 때 점성, 밀도, 산화적 안정성에서 만족하는 값을 보여주었다. 하지만 CN, IV, SV에 있어서는 바이오 디젤로서 다소 충족하지 못하는 결과를 보여주었는데, 이는 다량의 PUFA의 비율이 높은 IV 값과 낮은 CN 값의 산출에 기여하기 때문이다. 일반적으로 SFA, MUFA함량이 높을수록 CN 값이 높아지고, PUFA의 함량이 증가할수록 CN 값이 낮아지는 것으로 알려져 있다(Islam et al. 2013). 이러한 결과들을 바탕으로 바이오 디젤 안정성을 위해 다양한 척도를 사용하는 이유는 단순히 불포화지방의 존재만 작용하는 것이 아닌, 이중결합의 위치 역시도 중요하게 작용하기 때문임을 확인할 수 있으며 다양한 배양조건 변화를 통해 포화 및 불포화지방산의 비율을 조절한다면 CN값에도 유의미한 변화를 줄 수 있을 것으로 생각된다(Saluja et al. 2016).
Table 4.
FAME profiles of C. rubescens KNUA201 biomass.
4. 결론
본 연구는 울릉도로부터 유용 미세조류 생물자원을 탐색하고 개발하는 목적으로 순수분리를 진행하고 형태학적 및 분자생물학적 동정을 수행하였다. 이후 배양 및 수확을 통해 바이오매스 생화학적 조성을 조사하였으며 분리한 C. rubescens KNUA201은 59%의 높은 단백질 함량이 특징적이었으며, 이는 기능성 식품 생산에 사용될 수 있음을 시사하였다. 미세조류 바이오매스의 지방산 분석으로부터는 주로 C16, C18 길이의 지방산이 확인되었으며, 다중 불포화지방산인 알파 리놀렌산이(C18:3 (ω3)) 약 30%로 가장 높게 나타났다. 이로서 식물성 식품 보조제의 원료로서 사용될 수 있는 것을 확인하였다. 지방산 결과를 바탕으로 진행된 바이오 디젤 특성 평가에서 국제 규격을 만족하지 못하는 항목과(CN, IV, SV) 만족하는 항목(υ, ρ, OS)이 혼성되어 나타났다. 다만 이번 결과가 바이오 디젤 생산을 위해 마련한 최적의 환경이 아니었음에도 획득한 것임을 생각하였을 때, 추후 다양한 스트레스 환경하에서의 지방산 조성 변화 및 바이오 디젤 특성평가에 대해 연구해 볼 가능성이 있다고 사료된다. 결과적으로 C. rubescens KNUA021 균주의 바이오매스는 식이 보충제로서 잠재력을 가지고 있는 것으로 확인되었으며 차세대 바이오 에너지원으로서 유망한 후보군이 될 것으로 예상된다.