1. 서론
2. 재료 및 방법
2.1 실험재료
2.2 성게 추출물의 제조
2.3 세포배양
2.4 세포독성측정
2.5 NO 생성능 측정
2.6 Real-time PCR을 통한 유전자 발현양상분석
2.7 B16F10 세포에서 멜라닌 생성 억제 실험
2.8 Tyrosinase 활성 저해능 측정
2.9 통계분석
3. 결과 및 고찰
3.1 성게 추출물의 추출수율
3.2 세포독성
3.3 NO생성 억제능 측정
3.4 Real time PCR을 이용한 mRNA 발현량 측정
3.5 멜라닌 생성 및 tyrosinase 활성 억제능 측정
1. 서론
성게는 극피동물문(Phylum Echinodermata), 성게강(Echinoidea)에 속하는 해양 무척추동물로서 주로 연안에서부터 수심이 깊은 곳까지 분포되어 있다(Lee et al. 2010). 세계적으로 한국의 동해, 중국, 일본 연안에 분포되어 있는데, 우리나라 연근해에서 발견되는 성게류는 보라성게(Anthocidaris crassispina), 말똥성게(Hemicentrotus pulcherrimus), 분홍성게(Pseudocentrotus depressus) 등이다(Ryo and Park 1986), 성게의 주요 성분은 수분, 단백질, 지방, 비타민 B군과 비타민 C, 철분, 마그네슘 및 칼슘 등인데(Lee et al. 2010), 종에 따라, 동종도 부위에 따라, 혹은 생산 시기와 섭식 환경에 따라 다양한 생리활성을 나타낸다(Aneirose and Garateix 2004). 이러한 해양생물 유래 화합물에는 해조 다당류, 미네랄, 비타민, 항산화제, 효소 및 생리활성 펩타이드로 구성되어 있다(Kim et al. 1999; Pomjponi 1999).성게의 주성분은 단백질과 지질이며 비타민 A와 아연이 풍부해 시력 향상, 피부나 점막 유지, 노화방지, 암예방 등에 효과적이며 비타민 B군과 칼슘을 다량 함유하고 있어 피부비용, 노화방지 및 골다공증 예방 등에 효과적이라고 알려져 있다(Lee et al. 2010; Yu 1999).
성게에 대한 국내외 연구는 대부분 생리활성에 대한 것으로 보라성게 추출물의 간해독과 항산화 효과(Lee et al. 2010), 성게알의 아미노산과 지방산 조성(Nam 1986), 성게로부터 분리한 β-galactosidase의 정제 및 특성(Kim et al. 1998), 말똥성게 분획물에 의한 항 발암 및 항산화 효과 등에 관한 연구보고(Shin and Bae 2009)는 있으나, 성게를 활용하여 식품과 화장품 소재로 사용하기 위한 연구는 미비한 실정이다(Lee et al. 2012).
성게는 식용되는 생식소 부위가 약 20%이고 나머지는 80%는 성게 껍질로 구성되어 있으며, 성게의 연간 평균 생산량 2,500톤을 기준으로 약 2,000톤이 폐자원으로 버려지고 있어 환경 문제로 대두되고 있는 실정이다(Korea Agro-Fisheries Trade Corp. 2000). 최근 한국의 연근해는 무분별한 해안개발과 오염물질의 유입, 수온상승 및 조식동물에 의한 갯녹음 현상의 확산 등으로 해조류 자원이 급격히 감소되고 있는 실정이며, 이로 인한 직·간접적인 피해가 확산되고 있다. 우선 해양의 1차 생산자인 해조가 감소됨으로써 해조를 섭식하는 유용 수산 생물인 전복, 소라, 성게 등의 무척추동물과 연안에 분포 서식하고 있는 어류 등 해조 군락지를 산란장으로 이용하는 수생생물이 소멸되고, 해조류에 서식하는 미세동물이 감소됨으로써 해양 생태계의 균형이 깨져 해양의 기초 먹이사슬 파괴가 초래되고 있다.
성게는 한국 동해안 일대에 대량 서식하고 있으며 왕성한 생식활동력과 견고한 외피 때문에 불가사리와 함께 천적이 별로 없는 동물로서 어린 해조류를 먹이로 삼아 해조류 고갈을 심화시키고 있다(Lee et al. 1998). 또한 해조류가 줄어든 뒤에는 석회 조류를 먹으며 생존하면서 해조류의 생장을 방해하므로 해조류 개체 수를 줄이는 데 상당한 역할을 하고 있다(Park 2010). 이러한 성게가 어장 내 대량 번식하여 유용 어·패류에 큰 피해를 주고 있어 현재 정부는 성게를 해적생물로 분류하여 구제비용 보조 등 성게 구제를 지원하고 있으며 매년 평균 20톤 정도 폐기처리되고 있는 실정이다.
따라서 본 연구는 연안 환경오염 저감 및 해양 생태계 평형 유지 방안 모색을 위하여 유해 해양생물인 성게를 활용하여 유용생리 활성 물질을 탐색하고 기능성 소재 물질을 확보함으로써 식품 및 화장품으로 실용화할 수 있는 고부가가치 산업화 소재를 개발하기 위해 성게의 효능을 분석하였다.
2. 재료 및 방법
2.1 실험재료
본 실험에 사용된 시료는 경북 포항에 위치한 한국수산자원공단 동해본부에서 매년 구제하고 있는 강원도 고성군, 경북 영덕군 성게를 받아 사용하였다. 본 실험에 사용된 RAW264.7 세포주와 B16F10 세포주는 American Type Culture Collection (ATCC)에서 구입하였고, 세포 배양에 사용한 Dulbecco’s modified Eagle’s medium (DMEM), fetal bovine serum (FBS) penicillin/streptomycin, trypsin-EDTA는 Gibco BRL (Grand Island, NY, USA)로부터 구입하여 사용하였다. DPPH (1-diphenyl-2-picrylhydrazyl), DMSO (dimethylsulfoxide), DMSO (dimethylsulfoxide),griessreagent, MTT (3-[4,5-methylthiazol-2-yl]-2, 5-diphenltetra zolium bromide)는 Sigma (St. Louis, MO, USA)에서 구입하여 사용하였고, ABTS{2,2’-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid)} 시약은 Wako Chemical (Osaka, Japan)에서 구입하여 사용하였다.
2.2 성게 추출물의 제조
성게를 껍질과 알 및 내장으로 분리하여 흐르는 물에 세적 후 동결건조하여 실험에 사용하였다. 동결건조된 시료를 분쇄한 후 시료의 10배에 해당하는 양의 70% 에탄올을 첨가하여 실온에서 12시간 180 rpm으로 교반 추출하여 원심분리하였다. 얻어진 상등액을 감압농축기를 이용하여 농축한 후 동결건조하여 –80℃에서 보관하며 사용하였다.
2.3 세포배양
본 연구에서 효능측정을 위해 사용한 세포는 마우스 흑색종 세포인 B16F10 세포와 마우스 대식세포인 RAW264.7로 American Type Culture Collection (ATCC, CRL-1635)에서 분양받아 사용하였다. 세포배양은 10% fetal bovine serum (FBS)과 1% penicillin/streptomycin (100 U/mL)을 첨가한 Dulbeco’s modified eagle’s medium (DMEM, Gibco Co, Gaithersburg, MD, USA) 배지를 사용하였으며, CO2 배양기(37℃, 5% CO2, Sanyo, Japan)에 계대배양하였다.
2.4 세포독성측정
성게 추출물의 세포독성을 측정하기 위하여 RAW264.7 세포와 B16F10 세포를 각각 96 well culture plate에 100 μL의 배지와 함께 24시간 배양한 다음, 추출물을 처리하여 24시간 배양하였다. 각 well에 MTT 용액을 최종농도가 5 μg/mL이 되도록 첨가한 후 3시간 동안 배양하면서 환원 반응을 유도하였으며, DMSO를 첨가하여 형성된 formazan 결정을 용해하였다. 발색 정도는 분광광도계를 이용하여 570 nm에서 흡광도를 측정하여 백분율로 표시하였다.
2.5 NO 생성능 측정
NO 생성능 측정은 RAW264.7 세포를 96 well plate에 1×106 cells/mL이 되도록 분주하고 24시간 배양하였다. 24시간 후 배지를 제거하고 (-)DMEM 배지로 희석한 성게 추출물을 농도별로 처리하고 1시간 후 LPS를 2 μg/mL의 농도로 처리하여 24시간 배양하였다. 이후 상등액 100 μL에 griess 시약 100 μL를 반응시켜 540 nm에서 흡광도를 측정하여 대조군과 NO 생성능을 비교하였다.
2.6 Real-time PCR을 통한 유전자 발현양상분석
성게 에탄올 추출물을 넣어 배양시킨 세포에 배지를 제거하고 PBS로 세척한 후 trizol 시약을 처리하여 RNA를 분리하였다. 분리된 RNA에 각각의 primer (Genotech, Daejeon, Korea)와 One step SYBR PrimeScriptTM RT-PCR kit (Takara, Ohtsu, Japan)를 넣고 Real-time PCR Detection System (ECOTM, Illumina, CA, USA)을 이용하여 증폭하였다. 유전자 발현 분석에 사용된 primer의 서열은 Table 1과 같이 나타내었으며, PCR 조건은 초기변성 95℃ 30초, 변성은 95℃ 5초, annealing은 57℃ 15초, 신장반응은 72℃ 10초로 하여 40 cycle을 수행했다. 용해 곡선은 55℃에서 시작하여 95℃를 종말점으로 0.5℃씩 상승시키며 80번을 수행하여 원하는 형광 값을 검출하였다. mRNA의 상대적 발현량은 control에 대한 sample의 상대적 유전자 발현 값으로 나타내었다.
Table 1.
Anti-inflammatory primer sequences used for real-time PCR.
2.7 B16F10 세포에서 멜라닌 생성 억제 실험
B16F10 세포를 배양하여 24 well plate에 5×104 cells/well에 분주하고 24시간 동안 배양한 후 시료와 분화 시약인 Alpha-Melanocyte stimulating hormone (α-MSH)를 250 μM 투여하여 72시간 동안 24시간마다 배지를 교체하면서 멜라닌 생성을 유도하였다. 72시간 배양한 후 각 well을 PBS로 세척하고 Cell lysis buffer (0.1 M sodium phosphate buffer, 1% triton X-100, 0.2 mM PMSF)를 분주하여 세포를 분리하고 상층액을 이용하여 단백질을 정량하고 세포에는 1N NaOH에 10% DMSO가 함유된 용액을 300 μL 첨가하여 100℃에서 10분간 용해시켜 450 nm에서 흡광도를 측정하여 멜라닌 함량을 측정하였다.
2.8 Tyrosinase 활성 저해능 측정
Tyrosinase 활성 저해능 측정은 0.1 M sodium phosphate buffer (pH 6.8) 1 mL에 10 mM L-3,4-dihydroxypheny-lalanine (L-DOPA)를 녹인 기질액 140 μL 및 세포 배양 상등액 60 μL의 혼합액을 37℃에서 1시간 반응시켜 반응액 중에 생성된 DOPA chrome을 475 nm에서 측정하였다. Tyrosinase 저해 활성은 α-MSH처리구와 무 첨가구의 흡광도 감소율로 나타내었다.
2.9 통계분석
모든 분석결과는 3회 반복한 실험의 평균과 편차로 나타내었다. 실험 결과는 SPSS 25.0 버전을 사용하여 mean ± SD로 나타내었으며, 각 군 간의 차이는 ANOVA로 분석하였으며, 유의수준은 p < 0.05로 하였다.
3. 결과 및 고찰
3.1 성게 추출물의 추출수율
천연자원 추출물을 산업적으로 활용하기 위한 추출 수율은 중요한 요소이다(Kim et al. 2011). 본 연구에서는 흔히 천연물에서 극성, 비극성 물질을 우수하게 추출 해 내는 농도로 잘 알려져 있는 70% 에탄올을 추출 용매로 선정하였다. 영덕에서 구제한 성게 에탄올 추출물의 추출수율은 17.9%로 나타났으며, 고성에서 구제한 성게의 추출 수율은 16.8%로 측정되어 구제 지역에 따른 추출수율 차이는 약 1% 정도로 비슷한 수준으로 나타났다(data not shown).
3.2 세포독성
성게 추출물에 대한 세포 독성을 측정하기 위하여, MTT assay를 이용하여 RAW264.7 세포와 B16F10 세포에 대한 세포독성을 측정하였다. 그 결과 추출물을 처리하지 않은 대조군의 세포 생존율을 100%로 보았을 때, 영덕과 고성 지역 성게 에탄올 추출물 모두 400 μg/mL의 농도까지 두 세포에서 세포생존율이 90% 이상으로 나타났다(Fig. 1(A), (B)). 따라서 세포 독성의 영향이 나타나지 않은 100, 200, 400 μg/mL의 농도로 성게 추출물을 세포에 처리하여 항염증 및 미백 효능을 측정하였다.
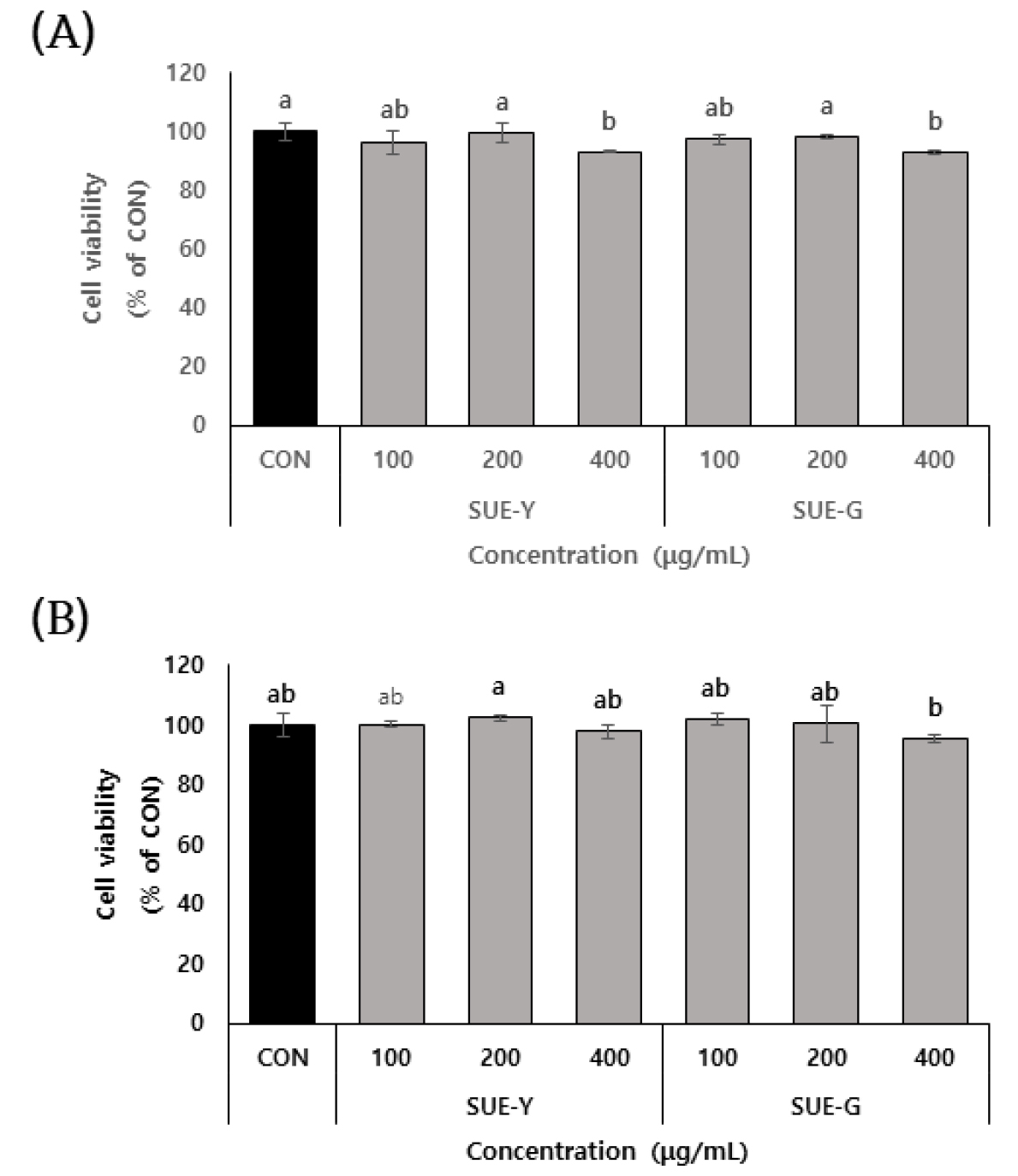
Fig. 1
Cytotoxic Effects of Youngdeok sea urchin extracts (SUE-Y) and Goseong sea urchin extracts (SUE-G) on RAW264.7 cells (A) and B16F10 Cells (B). Each value is expressed as the mean±SD of three independent experiments. Values with the same superscript letters are not significantly different from each other at p<0.05.
3.3 NO생성 억제능 측정
대식세포에서 NO의 생성은 염증 반응에서 중요한 역할을 한다(Martel-Pelletier et al. 2003). NO의 과한 생성은 염증을 심화시켜 여러 세포 및 조직의 손상을 야기하며, 만성 염증 질환 및 자가 면역 질환 등을 일으키는 것으로 알려져 있다(Kang et al. 2011). 이러한 역할을 하는 NO에 대하여 성게 추출물이 미치는 영향을 알아보기 위하여 LPS를 이용하여 NO 생성을 유도한 RAW264.7 세포에 대한 성게 추출물의 NO 생성 억제 활성을 측정하였으며, 측정한 결과는 Fig. 2에 제시하였다. LPS 처리군의 NO 생성량을 100%로 보았을 때, 영덕 지역에서 구제한 성제의 에탄올 추출물은 100, 200, 400 μg/mL의 농도에서 각각 2.77, 12.71, 31.44% 감소시켰고, 고성 지역의 성게의 경우 동일 농도에서 각각 4.5, 12.01, 34.34% NO 생성을 감소시켰다. 영덕 및 고성지역에서 구제한 성게 에탄올 추출물에서 농도가 증가함에 따라 NO 생성량이 유의미하게 감소하였다(p<0.05).

Fig. 2
Effect of Youngdeok sea urchin extracts (SUE-Y) and Goseong sea urchin extracts (SUE-G) on nitric oxide product level in RAW 264.7 cells. Each value is expressed as the mean±SD of three independent experiments. Values with the same superscript letters are not significantly different from each other at p<0.05.
3.4 Real time PCR을 이용한 mRNA 발현량 측정
iNOS (inducible nitric oxide synthase)는 생체 내에서 염증 반응에 동반되는 일산화질소(NO) 생성을 담당하는 효소이며, COX-2 (cyclo oxygenase-2)는 염증반응을 촉진시키는 프로스타글란딘(prostaglandin)을 생산하는 효소이다(Hur et al. 1999; Sato et al. 1997). 대식세포는 염증 유발 물질인 LPS에 의해 iNOS, COX-2, NO 생성을 증가시키고, 염증성 cytokine을 분비시켜 염증을 유발한다고 알려져 있다(Hinz and Brune 2002). NO 생성을 우수하게 억제시켰던 고성지역 성게 추출물을 이용하여 RAW 264.7세포에서 iNOS, COX-2의 mRNA 발현을 측정한 결과 Fig. 3과 같이 나타났다. iNOS와 COX- 2 모두 성게 추출물 100, 200, 400 μg/mL 농도에서 농도가 증가함에 따라 유의미하게 NO 생성이 감소되는 것을 확인하였다. 따라서 성게 추출물은 항염증에 우수한 효능을 나타내는 것으로 판단되며, 염증 관련 건강 기능성 식품 및 화장품 등으로 널리 사용될 가능성이 있는 것으로 사료된다.
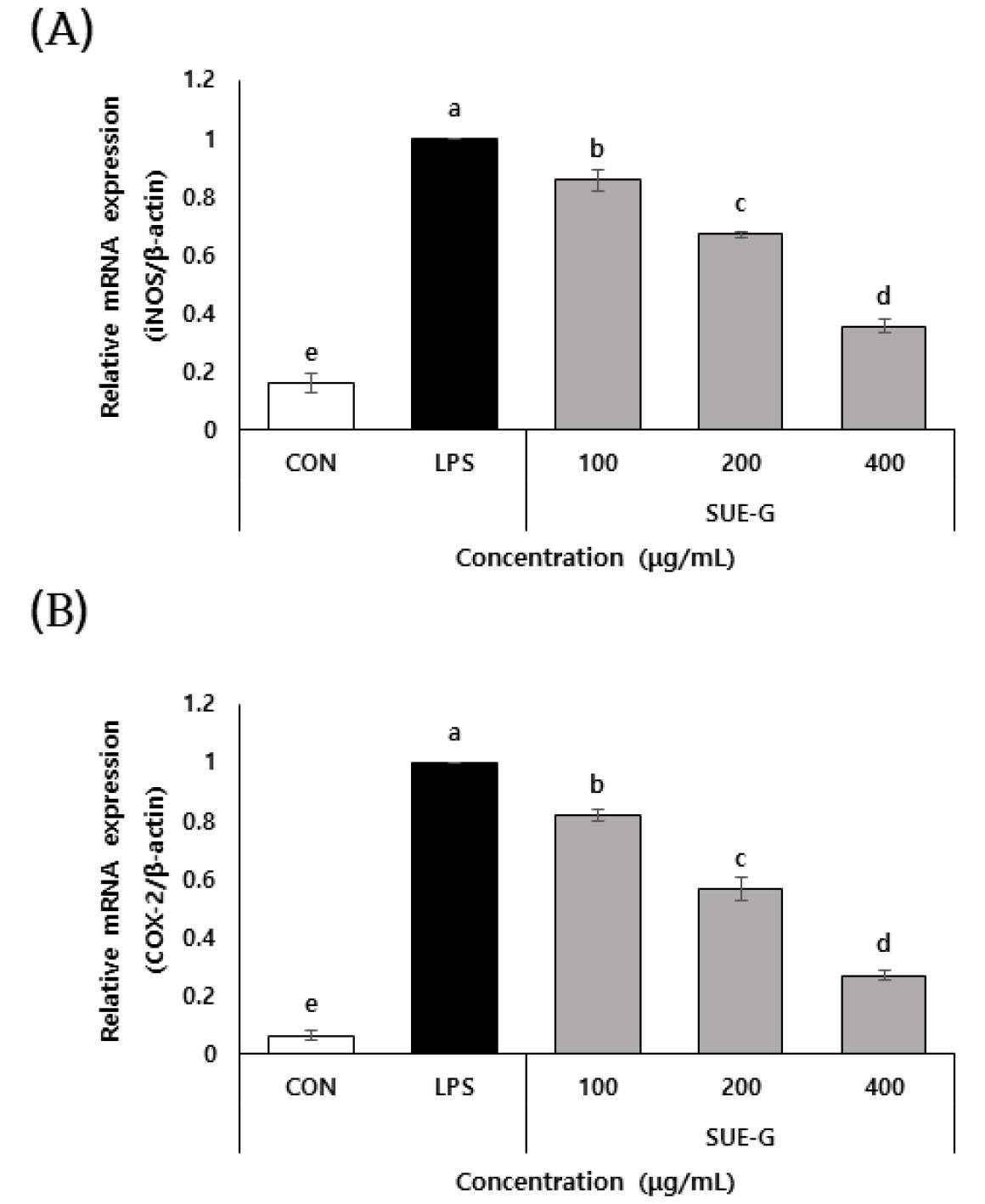
Fig. 3
Inhibitory effects of Youngdeok Sea Urchin Extracts (SUE-Y) and Goseong Sea Urchin Extracts (SUE-G) on the mRNA levels of iNOS(A) and COX-2(B).Each value is expressed as the mean±SD of three independent experiments. Values with the same superscript letters are not significantly different from each other at v<0.05.
3.5 멜라닌 생성 및 tyrosinase 활성 억제능 측정
멜라닌은 피부색을 결정하는 중요한 인자로 자외선에 의한 DNA 손상 등으로부터 피부 세포를 보호하는 역할을 한다(Gilchrest et al. 2009). 그러나 멜라닌이 과도하게 생성되면 주근깨, 기미 등을 만들며 피부 노화를 촉진시키고 피부암 등을 유발한다.
이러한 멜라닌 생성에 성게 추출물이 미치는 영향을 측정하였다. B16F10 세포에 대한 성게 추출물의 미백 효능을 측정하기 위하여 세포 독성이 나타나지 않은 농도 범위인 100, 200, 400 μg/mL에 대하여 melanin 생성 양을 측정한 결과, melanin 생성을 유도한 α-MSH 처리군에 비하여 영덕지역 성게는 각 농도에서 10.23, 20.33, 41.71%, 고성지역 성게는 동일한 농도에서 11.36, 21.46, 45.44%로 두 지역 성게 추출물 모두 농도 의존적으로 감소하는 것을 확인하였다(Fig. 4(A)). 특히 성게 추출물은 400 μg/mL의 농도에서는 피부 미백에 효능이 있다고 알려진 고시형 소재인 arbutie (100 μg/mL)과 유사한 정도로 melanin 생성을 억제하는 것으로 확인되었다.
멜라닌 생성 억제능 뿐만 아니라 멜라닌 생성에 중요한 역할을 하는 tyrosinase 효소 활성 억제능을 측정한 결과 또한 농도 의존적으로 효소 활성을 억제하는 것으로 확인되었다(Fig. 4(B)).

Fig. 4
Effect of Youngdeok Sea Urchin Extracts (SUE-Y) and Goseong Sea Urchin Extracts (SUE-G) melanin content (A), tyrosinase activity (B) in B16F10 cells. Each value is expressed as the mean±SD of three independent experiments. Values with the same superscript letters are not significantly different from each other at p<0.05.
이번 실험으로 성게 추출물이 멜라닌 생성과 tyrosinase 효소 활성 억제능이 우수한 것으로 나타나 미백 효능에 우수한 소재로서의 가능성은 확인했지만, 멜라닌 합성은 tyrosine을 기질로 tyrosinase, tyrosinase related protein-1 (TRP-1), tyrosinase related protein-2 (TRP-2)에 의해 DOPA quinone으로 전환되고 자동산화반응과 효소반응으로 DOPA chrome을 거쳐 멜라닌을 생성하게 된다(Ferguson and Kidson 1997; Hearing and Tsukamoto 1991). 따라서 미백 효능에 영향을 미치는 유전자 분석과 같은 작용기전 구명을 통하여 성게의 미백 활성에 대한 추가적인 확인이 필요하다.