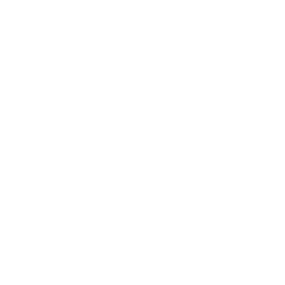1. 서론
2. 재료 및 방법
2.1 배양 조건
2.2 발광다이오드 단일 파장 및 복수파장에 따른 C. vulgaris의 색소 함량 변화
2.3 발광다이오드 2단계 배양에 따른 C. vulgaris의 색소 함량 변화
2.4 광주기 조절에 따른 C. vulgaris의 색소 함량 변화
2.5 발광다이오드 다중파장에 따른 C. vulgaris의 색소 함량 변화
2.6 HPLC를 이용한 C. vulgaris 색소 함량 측정
3. 결과 및 고찰
3.1 발광다이오드 단일 파장 및 복수파장에 따른 C. vulgaris의 색소 함량 변화
3.2 발광다이오드 2단계 배양에 따른 C. vulgaris의 색소 함량 변화
3.3 광주기 조절에 따른 C. vulgaris의 색소 함량 변화
3.4 발광다이오드 다중파장에 따른 C. vulgaris의 색소 함량 변화
4. 결론
1. 서론
미세조류는 광합성 대사를 통해 생장하는 독립영양생물로써, 해양생태계의 기초생산을 제공하는 중요한 역할을 한다(Han and Oh 2018). 또한 미세조류는 산업적으로 가치를 지니는 다량의 지질과 탄수화물을 축적할 뿐만 아니라, 카로티노이드 계통의 이차대사물질 등 다양한 유용물질을 생산해내어(Ko et al. 2016), 식량 대체 자원, 건강보조식품, 양식 사료 및 각종식·의약품 등의 다양한 분야에서 활용되고 있다(Bentahar et al. 2023).
미세조류가 축적하는 다양한 유용물질들은 염분, 수온, 영양염 및 광 조건 등의 여러가지 요인들에 의해서 생산량이 결정되며(Oh and Lee 2023), 생산성을 고려한다면 배양 환경 인자의 최적화가 필수적이다(Schenk et al. 2008; Jo and Cha 2010). 그 중 파장과 광량과 같은 광 조건은 광합성 생물인 미세조류에게 중요한 요소로 작용한다(Saavedra and Voltolina 1994). 특히 파장의 변화는 광합성 색소, 항산화물질 및 지질과 같은 유용 생리활성 합성을 촉진하기 때문에, 다양한 산업적 분야에서의 활용이 기대되고 있으며(Oh et al. 2015), 다른 환경요인 조절보다 비교적 저비용이며, 비교적 복잡하지 않은 공정으로 조절할 수 있다.
이러한 미세조류의 산업적인 이용을 위해서는 원활한 바이오매스 생산이 요구되기에 대량배양이 필수적이며(Kim and Choi 2014), 현재 미세조류의 대량배양 방법은 개방형 배양(open pond)과 밀폐형 배양장치(photo-bioreactor, PB)로 구분된다(Kim et al. 2007). 이 중 PB는 미세조류의 생장에 적합한 광량과 파장을 공급할 수 있어 고부가가치 기능성 물질 생산에 유리하지만, 이를 보조하기 위한 인공 광원이 필수로 요구된다(Vasudevan and Briggs 2008). 하지만 일반적인 광원으로 사용되는 형광램프의 경우 발광체의 특성상 큰 부피를 차지하여 비용적, 공간적인 면에서 단점을 가지고 있으며, 수은(10~50 mg), 납(10~12%)과 같은 중금속을 함유하고 있어 환경오염을 초래할 수 있다(Lee et al. 2005).
발광다이오드(Light Emission Diode; LED)는 광원 효율이 100 lm/W 정도로 형광등과 유사한 값을 보이나, 약 8만 시간의 수명을 가지고 있어 약 2만 시간의 수명을 가진 형광램프보다 경제성을 가진다(Carvalho et al. 2011). 또한 특성상 침수에 약한 형광램프와 다르게 LED는 간단한 방수처리를 통해 PB 내부로 넣을 수 있으므로 소모되는 전력량은 적어지고, 빛의 이용 효율은 높아져 더욱 많은 바이오매스를 얻을 수 있다(Wang et al. 2007). 그리고 LED는 전압전류 변화량에 따른 광량 조절이 가능하고, LED 칩 크기가 매우 작아 다양한 파장의 칩을 조합할 수 있어, 파장과 밝기 조절이 자유롭게 가능하다(Kim et al. 2011). 따라서 LED는 배양하고자 하는 미세조류 종의 광합성에 유리한 파장만을 조사할 수 있어, 미세조류의 이차대사물질의 생산을 강화시켜 상업적으로 유리한 배양이 가능하다는 연구결과가 다수 보고 되어 있다(Lee and Plasson 1994; Katsuda et al. 2004; Menon et al. 2013).
한편, Münzner and Voigt (1992)의 연구에 따르면 Haematococcus pluvialis가 청색파장에서 astaxanthin의 생산효율이 가장 높다고 보고하였으며, Katsuda et al. (2004)는 H. pluvialis가 적색 파장과 청색 파장을 이용한 2단계 배양에서 astaxanthin과 바이오매스의 함량이 가장 높았다고 하였다. 또한 Chen et al. (2010)은 남조류 Spirulina platensis가 청색 파장에서 Fuchoxanthin의 축적능이 가장 높아졌다고 보고하였으며, 녹조류 Chlorella vulgaris는 녹색 파장에서 chorophyll-a (chl-a)의 함량이 높아진다고 하였다(Mohsenpour and Willoughby 2013). 녹조류 Dunaliella salina는 청색과 적색파장을 혼합한 혼합파장을 주사하였을 때, lutein과 β-carotene의 함량이 높다고 하였으며(Fu et al. 2013), Tetraselmis suecica는 청색 파장에서 chl-a의 함량이 가장 높았다(Abiusi et al. 2014).
본 연구의 실험종인 C. vulgaris는 광합성 색소 chl-a, chl-b, β-carotene 및 astaxanthin과 같은 carotenoid계 항산화색소, canthaxanthin 및 lutein의 고생산이 가능하며, 비타민, 무기질, 미네랄 및 아미노산 등 각종 영양소가 풍부하여 고부가가치 식품, 의약품 및 건강보조식품의 원료 생산등으로 활용분야가 확대되고 있다(Mendes et al. 1995; Kitada et al. 2009; Safi et al. 2014; Kim et al. 2023). 또한 C. vulgaris도 다른 미세조류와 같이 환경 조건 변화를 통한 스트레스 인자를 적용시켜 세포 내의 유용물질을 증진시킬 수 있으나, 동일 종이더라도 연구자에 따라 광에 대한 생리적 특성 및 파장 이용성이 다르게 보고되고 있다. 따라서 본 연구에서는 고효율과 기능성을 겸비한 광생물반응기(photo-bioreactor, PB) 구축을 위해 산업적 가치가 높은 C. vulgaris의 광합성 색소에 미치는 LED 광량과 파장의 영향을 파악하고자 한다.
2. 재료 및 방법
2.1 배양 조건
실험에 사용된 녹조류 C. vulgaris는 wild type PKVL7422이었다. 배지는 초순수이온수를 바탕으로 한 BG11 (Stanier et al. 1971) 배지를 이용하였다. 유지배양은 수온과 염분이 각각 20℃, 0 psu였으며, 광량은 약 100 μmol·m-2·s-1 (12L:12D, cool-white fluorescent lamp)에서 배양하였다. 모든 배양은 무균화 작업은 수행하지 않았지만, 2차적인 생물학적 오염을 막기 위하여 실험기구는 고압(202 kPa, 30 min) 또는 건조멸균(185℃, 1 hr)하여 사용하였으며, 모든 실험은 Clean bench에서 수행되었다.
2.2 발광다이오드 단일 파장 및 복수파장에 따른 C. vulgaris의 색소 함량 변화
서로 다른 파장에서 C. vulgaris 색소 함량 변화는 단일 파장의 경우, 청색 파장(λmax=450 nm; LUMILEDS, Mansfield, TX, USA), 녹색파장(λmax=520 nm; LUMILEDS) 및 적색파장(λmax=660 nm; LUMILEDS)이었으며, 복수파장은 형광램프(삼파장등; Namyung Lighting Corp., Seoul, Korea)를 이용하였다. 광원별 광량은 가시광선 차단필름을 이용하여 10과 100 μmol·m-2·s-1 (QSL-2100; Biospherical Instrument Inc., San Diego, CA, USA)의 2단계로 조절하였으며, 명암주기는 12 L (light):12 D (dark)가 되도록 하였다. 온도와 염분은 유지배양조건과 동일하며, C. vulgaris를 대수 생장기까지 생장시킨 후 1 L 배양플라스크에 세포밀도를 1.2×105 cells/mL가 되도록 접종하였다. 세포의 대수 생장기 중기와 정상기 여부는 이틀 간격으로 건중량(dry cell weight)을 측정하여 파악하였으며, 이 시기에 세포를 수확하여 색소 함량을 측정하였다. 여기에서 건중량 측정은 세포 배양액 10 mL을 여과(25 mm, GF/F)한 뒤, 여과지를 dry oven에서 75°C, 2시간 동안 건조하고 무게를 측정하였다.
2.3 발광다이오드 2단계 배양에 따른 C. vulgaris의 색소 함량 변화
Han et al. (2023)은 같은 종주(strain) C. vulgaris에서 높은 세포밀도를 얻을 수 있는 경제적인 광원인 적색파장과 유용물질 함량을 증진하는 청색파장을 생장단계별로 서로 달리 조사할 경우(2단계 배양), 경제적인 효과 및 생산성 증대에 기여할 수 있을 것으로 보고하였다. 따라서, 대수생장기 후기까지는 적색 파장을, 정상기 이후에는 청색 파장을 조사하여, 색소함량의 변화를 관찰하였다. 광량은 모든 파장을 100 μmol·m-2·s-1 (L:D=12L:12D)로 조절하였다. 온도와 염분은 유지배양조건과 동일하며, C. vulgaris를 대수 생장기까지 생장시킨 후 1 L 배양플라스크에 세포밀도는 1.2×105 cells/mL가 되도록 접종하였다. 세포밀도는 건중량을 측정하여 계산하였으며, 대수증식기와 정상기 세포를 수확하여 색소 함량을 측정하였다.
2.4 광주기 조절에 따른 C. vulgaris의 색소 함량 변화
광주기에 따른 생장실험을 위해, 청색 파장와 적색 파장에서 각각 암기가 없는 24L:00D부터 명기가 짧은 16L:08D 광주기까지 24L:00D. 16L:08D, 12L:12D로 총 3가지 광주기로 처리하였다. 온도와 염분은 유지배양조건과 동일하며, C. vulgaris를 대수 생장기까지 생장시킨 후, 1 L 배양플라스크에 세포밀도가 1.2×105 cells/mL가 되도록 접종하였다(광량: 약 100 μmol·m-2·s-1). 세포밀도는 앞선 실험과 같이 건중량을 측정하여 계산하였으며, 대수 생장기 중기와 정상기 세포를 수확하여 색소 함량을 측정하였다.
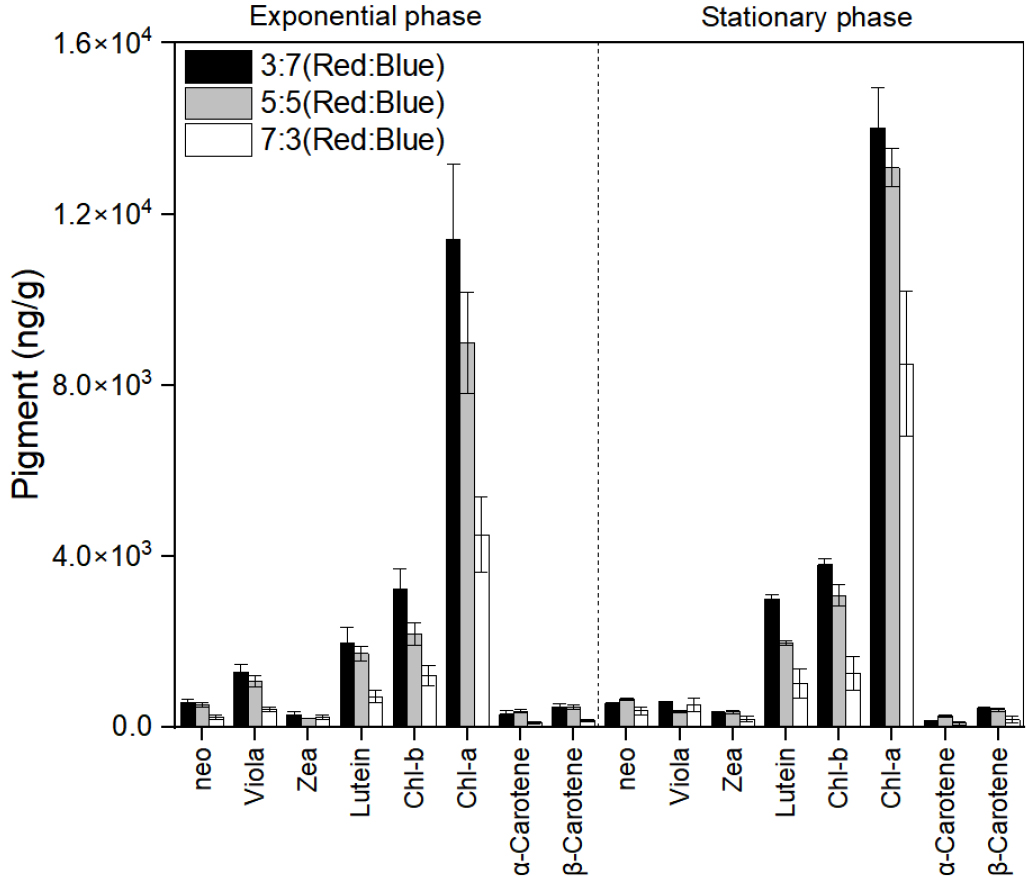
2.5 발광다이오드 다중파장에 따른 C. vulgaris의 색소 함량 변화
발광다이오드 다중 파장에 따른 생장실험을 위해 청색 파장와 적색 파장을 각각 5:5, 7:3, 3:7 비율로 혼합하여 광량은 약 100 μmol·m-2·s-1 (L:D=12L:12D)으로 조절하였다. 온도와 염분은 유지배양조건과 동일하며, C. vulgaris를 대수 생장기까지 생장시킨 후 1 L 배양플라스크에 세포밀도가 1.2×105 cells/mL가 되도록 접종하였다. 세포밀도는 건중량으로 측정하였고, 대수 생장기 중기와 정상기 세포를 수확하여 색소 함량을 측정하였다.
2.6 HPLC를 이용한 C. vulgaris 색소 함량 측정
색소는 Zapata et al. (2000)에 의거하여 HPLC system을 이용하여 분석하였으며, 색소 분리는 색소 분리는 Waters C8 column을 이용하였다(Table 1). Chromatogram의 peak에 대한 동정 및 농도의 계산은 표준색소(DHI water & Environment, Denmark)의 retention time 및 peak area와 비교하여 결정하였다. 색소분석을 위한 용매 system 그리고 각 색소의 추출 용매와 흡광계수는 Table 1에 제시하였다. 표준색소는 Chl-a, chlorophyll b (Chl-b), neoxanthin, violaxanthin, zeaxanthin, lutein, α- carotene 그리고 β-carotene을 구입하여 이용하였다. 모든 UV-VIS 검출기 자료를 사용하여, 정성·정량 하였으며, 형광자료는 Chlorophyll 계열의 색소를 정성하는데 보조자료로 활용하였다.
Table 1.
HPLC and solvent system.
3. 결과 및 고찰
3.1 발광다이오드 단일 파장 및 복수파장에 따른 C. vulgaris의 색소 함량 변화
주색소인 chl-a의 함량은 정상기 광량 100 μmol·m-2·s-1의 청색파장(11335.86 ng/g)에서 가장 높았고, 녹색파장(10031.79 ng/g), 형광램프(8469.04 ng/g), 적색파장(7695.56 ng/g) 순서로 나타났으며, 청색파장은 기존의 대량배양 광원인 형광램프와 비교하였을 때 1.3배 높은 chl-a 함량을 보였다(Fig. 1). 광량에 따라서는 10 μmol·m-2·s-1보다 100 μmol·m-2·s-1에서 높은 함량을 보였으며, 정상기에서 청색파장 100 μmol·m-2·s-1은 10 μmol·m-2·s-1보다 1.8배 높은 함량을 보였다(Fig. 1).
Vu et al. (2016)은 Rhodomonas salina가 낮은 광량(10 μmol·m-2·s-1)보다 높은 광량(100 μmol·m-2·s-1)에서 chl-a, chl-c 및 phycocyanin 함량이 증가된다고 하였다. 또한 녹조류 Brachiomonas submarina는 낮은 광량(15 μmol·m-2·s-1)의 청색파장보다 높은 광량(100 μmol·m-2·s-1)의 청색파장에서 보조색소인 lutein의 함량이 가장 높다고 하였으며(McGee et al. 2020), Tetraselmis sp.도 낮은 광량(33 μmol·m-2·s-1)보다 높은 광량(170 μmol·m-2·s-1)에서 높은 바이오매스 함량과 lutein 함량을 나타냈다고 보고하였다(Schüler et al. 2020). 이는 낮은 광량이 광합성에 필요한 에너지를 충분히 공급하지 못해 광합성 제한요소로 작용되어, 광합성 효율을 감소시켜 색소 합성을 저해시킨 것으로 판단된다(Carvalho et al, 2011; Ferreira and Sant’Anna, 2016). 또한 Zhang et al. (2023)에서 Emiliania huxley가 높은 세포밀도를 보였던 청색 파장에서 chl-a 함량이 가장 높다고 보고하였는데, Han et al. (2023)에서 같은 종주를 이용하여 광량에 따른 생장속도를 Lederman and Tett (1981)의 모델식으로 분석한 결과, 광량이 증가할수록 생장속도 및 바이오매스 함량이 증가하였다고 보고하였다. 따라서 광량 100 μmol·m-2·s-1 조건에서는 바이오매스 증가와 동시에 빛 에너지를 더욱 효율적으로 사용하기 위해, chl-a 합성을 증가시킨 것으로 판단된다.
또한 주색소인 chl-a와 보조 색소인 chl-b, violaxanthin 및 lutein의 함량은 광량 및 생장 단계와 관계없이 청색 파장에서 가장 높게 나타났으며, 형광램프와 비교하였을 때 각각 4.8배, 2.7배 및 1.2배 높은 함량을 보였다(Fig. 1). Katsuda et al. (2004)가 연구한 H. pluvialis는 청색 파장에서 보조색소인 astaxanthin의 축적능이 가장 높다고 하였으며, 규조류 Phaeodactylum tricornutum도 청색 파장에서 가장 높은 chl-a 함량을 나타냈다고 보고하였다(Schellenberger Costa et al. 2013). Baidya et al. (2021)가 연구한 C. ellipsoidea도 청색 파장에서 가장 높은 chl-a 및 chl-b 함량을 나타났다고 하여, 본 연구결과와 유사하였다. Kim and Choi (2014)은 청색 파장이 C. vulgaris의 세포 분열을 억제하는 유전자인 min D의 발현을 증가시키는 동시에 광계 I와 광계 II를 활성화시키는 유전자인 psa B 및 psb A를 발현시킨다고 보고하였다. 이는 단파장인 청색 파장이 미세조류에게 스트레스로 작용하여, 세포 분열을 억제시키고, 이에 따른 방어기작으로 광합성 기구 손상을 방지하는 carotenoid계 색소의 함량이 증가된 것으로 생각된다(Shariati and Hadi 2011; Soontornchaiboon et al. 2012). 미세조류의 carotenoid계는 주로 보조 색소 및 광합성 복합체의 구성요소로써 1차 carotenoid는 흡수된 에너지를 엽록소로 전달하는 역할을 하며, 2차 carotenoid는 과잉으로 공급받는 빛에너지를 흡수하여 소멸시킴으로써 광합성 기구를 보호하는 기능을 가지고 있다(Muller et al. 2001; Soontornchaiboon et al. 2012). 따라서 carotenoid계 색소인 lutein 및 violaxanthin이 청색파장에서 가장 높은 함량을 보인 것으로 판단된다(Wang et al. 2018). 또한 청색파장은 광합성 유전자 전사를 촉진시키고, 효소를 활성화시켜 미세조류의 광합성 색소를 자극하는 촉매 역할을 하며(Ruyters 1984), 청색광을 감지하는 광수용체인 크립토크롬(cryptochrome)을 활성화시켜(Ma et al. 2012), 광합성 효율을 높인다. 따라서 청색파장 하에서 미세조류는 세포분열이 억제되는 반면, 세포 분열에 사용될 에너지를 다른 대사 과정으로 전환하여 색소와 같은 유용물질을 증가시키는 것으로 판단된다.
3.2 발광다이오드 2단계 배양에 따른 C. vulgaris의 색소 함량 변화
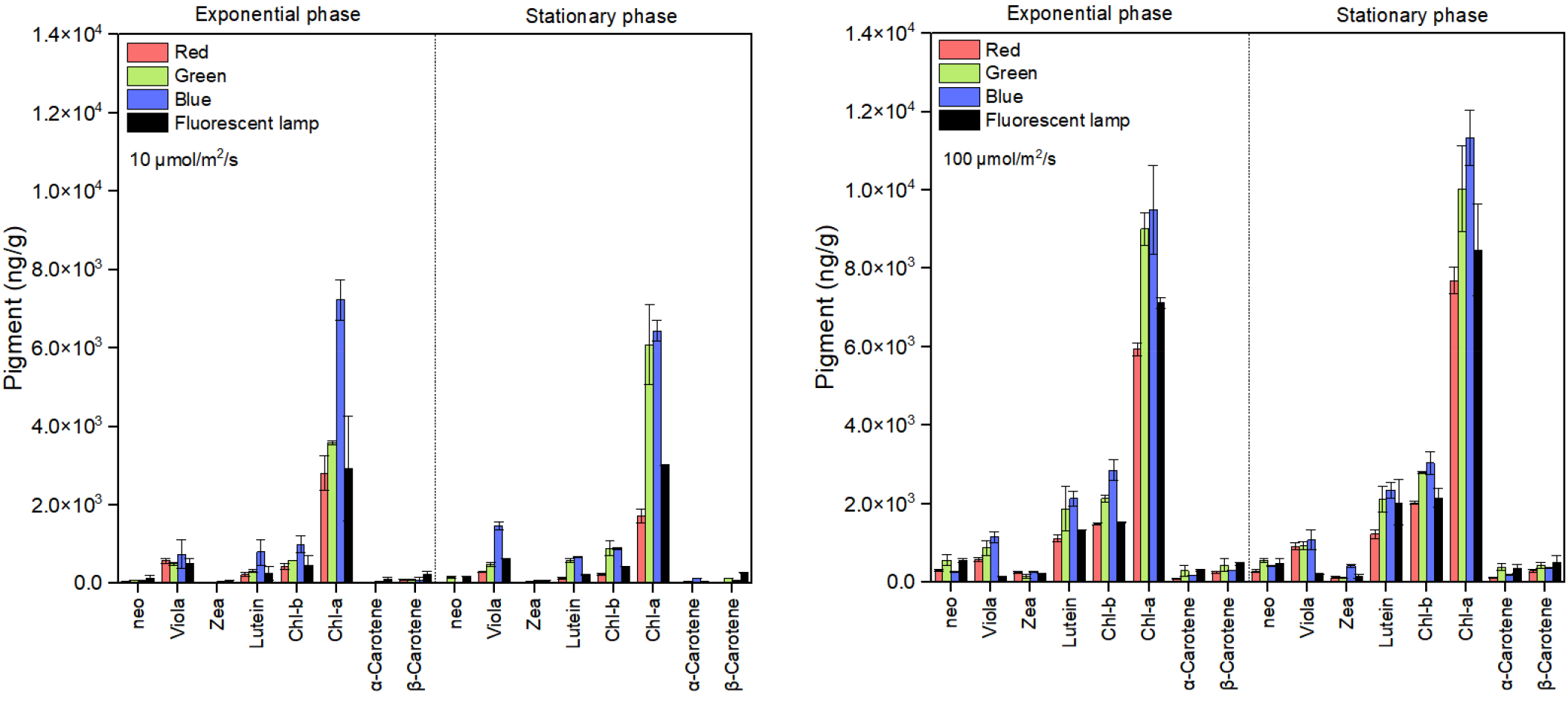
Han et al. (2023)에서 같은 종주를 이용하여 파장별 광량과 생장속도를 Lederman and Tett (1981)의 모델식으로 분석한 결과, 적색파장(0.95 /day)에서 높은 최대생장속도(maximum growth rate; μmax)를 보였으며, 특히 적색 파장에서 가장 낮은 광친화성지수(half-saturation light intensity; μmol·m-2·s-1; Ks; 47.08)을 나타내었다. 따라서 배양 초기에는 생장을 위한 최적 환경조건을 위해 적색 파장을 주사한 뒤, 정상기부터 색소 축적에 효과적인 청색 파장을 조사하였다.
주색소인 chl-a의 함량(8900 ng/g)은 정상기 광량 100 μmol·m-2·s-1 적색단일파장(7696 ng/g)과 비교하였을 때, 1.2배 높았으며, 보조색소인 lutein 및 violaxanthin의 함량은 각각 1408 ng/g, 994 ng/g으로 1.2배, 1.1배 높은 함량을 보였다(Fig. 2). Sui et al. (2019)는 광량의 증가 및 영양소 결핍을 이용한 2단계 배양에서 β-carotene이 축적된다고 하였으며, García-López et al. (2020)는 Arthrospira maxima가 대수생장기 후기까지 태양광을 주사하고, 정상기부터 청색파장을 주사하였을 때 phycocyanin 생산이 증가한다고 보고하였다. 이는 유용물질 촉진을 위한 파장의 변화가 미세조류에게 스트레스로 작용하여, 미세조류 체내에 항산화물질 및 기타 이차 대산물과 같은 화합물 생산과 같은 다양한 대사 반응을 유도한 것으로 판단된다(Jung et al. 2019). 하지만 본 실험에서 2단계 배양은 미세조류에게 스트레스를 주는 청색 파장을 지속적으로 주사하였을 때보다 색소 축적능이 낮게 나타났는데, 이는 갑작스러운 파장 변화가 오히려 미세조류의 바이오매스를 손실시켜 유용물질을 감소시킨 것으로 생각된다. 본 연구결과와 유사하게 Lee et al. (2017)은 D. salina의 온도 변화로 유도된 2단계 배양 실험에서 갑작스러운 온도 변화가 오히려 세포 밀도를 감소시켜, 탄수화물 및 지질의 함량이 감소하였다고 보고하였다. 또한 생장 단계에 따라 배양 조건을 변경하는 2단계 배양의 경우 미세조류의 종마다 변경 시점이 달라질 수 있어(Nagappan and Kumar 2021), 배양조건 변화에 따른 미세조류의 스트레스 반응 모니터링이 필요할 것으로 판단된다.
3.3 광주기 조절에 따른 C. vulgaris의 색소 함량 변화
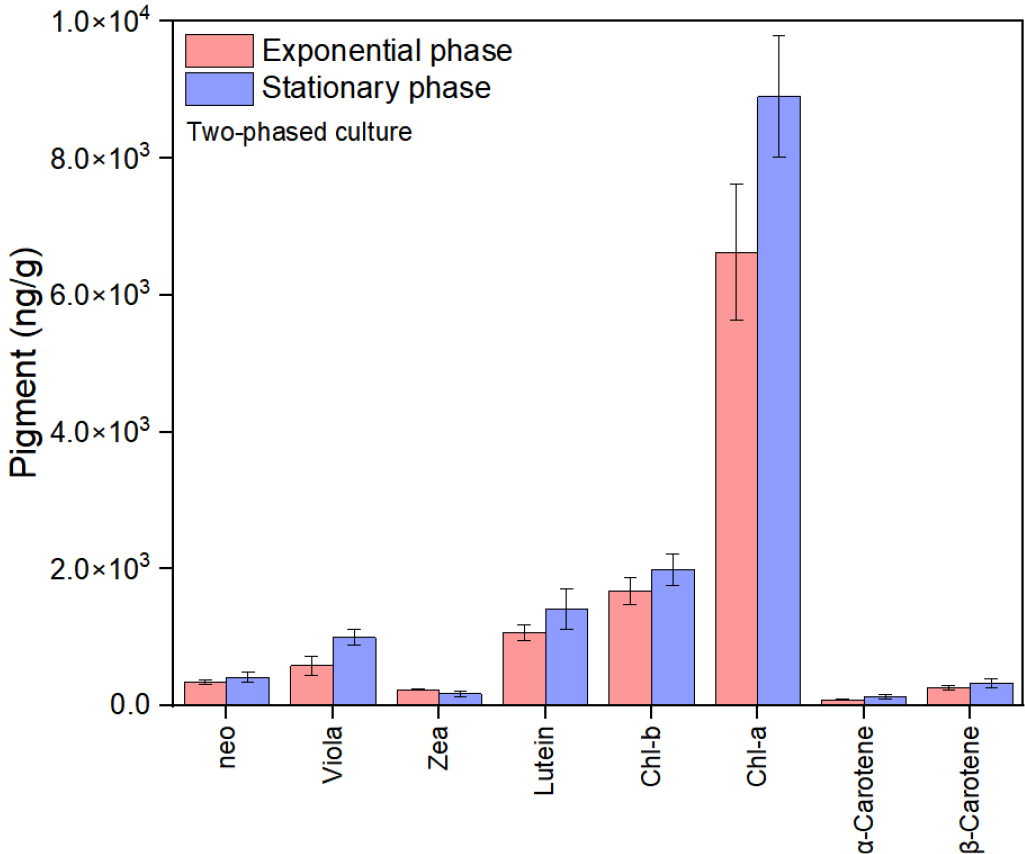
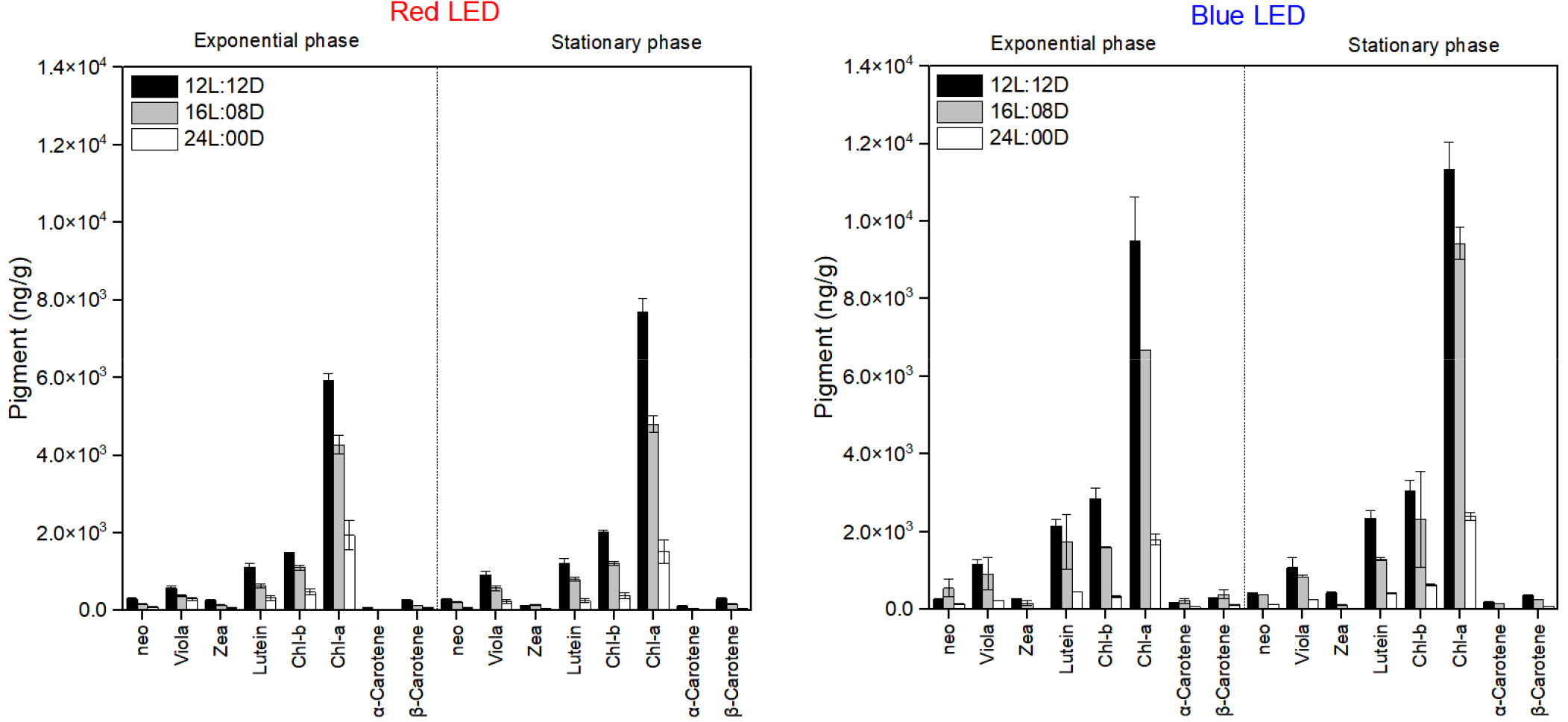
주색소인 chl-a의 함량은 정상기 청색파장 12L:12D (11336 ng/g)에서 가장 높았고, 16L:08D (9426 ng/g), 24L:00D (2400 ng/g)순서로 나타났으며, 적색파장에서도 청색파장과 같이 정상기 12L:12D (7696 ng/g), 16L:08D (4799 ng/g), 24L:00D (1516 ng/g) 순서였다(Fig. 3). 또한 보조색소 violaxanthin, zeaxanthin, lutein, chl-b 및 α-carotene의 함량은 생장단계와 파장에 관계없이 12L:12D 광주기에서 가장 높았다(Fig. 3). George et al. (2014)는 Ankistrodesmus falcatus가 12L:12D 광주기에서 가장 높은 chl-a 및 carotenoids 함량이었다고 보고하였으며, Khan et al. (2019)도 남세균 Pseudanabaena amphigranulata가 12L:12D 광주기에서 가장 높은 chl-a 함량을 나타냈다고 보고하여 본 연구결과와 유사하였다. 이는 12L:12D 광주기가 생장을 위한 충분한 광주기를 제공한 것으로 생각되며, 오히려 긴 광주기가 미세조류의 광합성 및 에너지 효율을 감소시켜, 궁극적으로 유용 물질의 생산을 저해시킨 것으로 판단된다(Sirisuk et al. 2018; Che et al. 2019). 또한 적절한 암기는 손상된 단백질 및 광합성 회로를 회복시키고, 활성산소종(Reative Oxygen Species; ROS)를 제거하여 세포 스트레스를 감소시켜, 전반적인 생산 속도를 높여주는 것으로 생각된다(Pulz 2001). 하지만 Fakhri et al. (2021)은 Chlorella sp.의 chl-a 및 carotenoids의 함량이 24L:00D의 긴 광주기에서 가장 높았다고 언급했으며, Kendırlıoglu et al. (2015)는 C. vulgaris의 chl-a 함량이 19L:05D의 주기에서 가장 높았다고 보고하였다. 따라서 이상적인 광주기를 평가하기 위해서는 다양한 종주에 대한 광에 대한 생리적인 현황을 살펴보는 것이 무엇보다 중요할 것으로 생각되며, 광주기 조절에 따른 전력 소비량 및 에너지 수요도 고려해야 할 것으로 생각된다(Maroneze et al. 2016).
3.4 발광다이오드 다중파장에 따른 C. vulgaris의 색소 함량 변화
색소의 함량은 정상기 3 (청색):7 (적색) 파장에서 가장 높게 나타났으며, chl-a의 함량이 14013 ng/g로 가장 높았다. 또한 함량순서는 5:5 파장(13085 ng/g), 3:7(8497 ng/g)순으로 나타났으며, 색소 축적능이 가장 높았던 청색파장보다 1.2배 높았다(Fig. 4). 또한 보조색소인 chl-b 함량도 chl-a와 유사하게 3:7 파장(3453 ng/g)에서 가장 높게 나타났으며, 5:5 파장(3077 ng/g), 3:7(1258 ng/g) 순서였으며, 청색 단일 파장보다 1.3배 높았다(Fig. 4). 또한 보조색소인 lutein 및 β-carotene도 각각 1.3배, 1.2배 증가하였다(Fig. 4). Pereira and Otero (2019)는 D. tertiolecta가 청색과 적색파장을 5:5로 혼합한 다중파장에서 청색과 적색 단일 파장보다 40% 높은 carotenoids 함량을 나타냈다고 하였으며, Liu et al. (2021)은 Chlorella sp.가 적색과 청색을 혼합한 다중파장(1:2)에서 chl-a, chl-b, carotenoids 함량이 청색 단일 파장보다 높다고 하였다. 또한 Najafabadi and Naeimpoor (2023)은 D. salina가 적색과 청색 파장을 혼합한 다중파장(6:4)에서 단일 백색 파장보다 더 많은 지질, carotenoids계 색소를 축적 시킨다고 보고하여 본 연구 결과와 유사하였다. 이는 광합성 이외의 대사 기능을 활성화하기 위해 적색 파장 이외에도 청색 파장의 광자가 최소 5~10% 필요하기에, 이를 충족할 수 있는 혼합파장에서 유용물질 축적이 효과적인 것으로 생각된다. 또한 Kim and Choi (2014)는 청색파장은 세포의 크기를 증가시키는 반면, 적색파장은 세포 분열을 촉진시킨다고 보고하였다. 따라서 혼합파장을 주사하였을 때, 적색 파장에 의한 세포 분열의 증가와 청색 파장에 의한 세포 크기 증가로 인하여 유용물질을 다량 축적할 수 있는 세포가 대량으로 번식하게 되는 시너지 효과가 발생되어, 혼합파장에서 더욱 효과적으로 유용물질이 축적되는 것으로 고려할 수 있을 것이다.
4. 결론
광량과 파장이 C. vulgaris의 색소 함량에 미치는 영향을 조사한 결과, 광량 100 μmol·m-2·s-1의 청색 파장에서 주색소인 chl-a와 보조 색소인 lutein 및 violaxanthin의 함량이 가장 높게 나타났으며, 이는 청색 파장이 미세조류에 스트레스를 주어 색소 합성을 촉진시키는 것으로 판단된다. 또한 12L:12D의 광주기가 미세조류의 색소 합성에 최적의 조건임을 발견하였으며, 이는 적합한 광주기가 광합성 회복과 세포 스트레스 감소에 기여한다고 판단된다. 또한 혼합 파장을 적용한 다중 파장 실험에서는 3:7 비율의 파장이 색소 축적을 극대화하는 것으로 나타나, 다양한 파장의 조합이 미세조류의 대사 활동에 미치는 긍정적인 영향을 시사한다. 따라서 추후 광배양 시스템에 3:7 비율의 혼합 파장을 활용한다면, 혼합 파장의 시너지 효과를 통해 미세조류의 색소 합성 및 바이오매스 생산 효율을 더욱 높일 수 있을 것으로 보인다. 이러한 결과는 미세조류 기반 바이오연료 및 생리활성 물질 생산에 있어 광 조건 최적화의 중요성을 강조하며, 이를 산업적으로 적용함으로써 바이오연료 및 고부가가치 물질의 효율적인 생산이 가능할 것으로 기대된다. 또한 본 연구는 지속 가능한 에너지 및 자원 활용 측면에서 중요한 기초 자료를 제공하며, 미세조류의 상업적 활용 가능성을 높이는 데 기여할 것이다.